
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
分析 (1)漏掉了钡离子与硫酸根离子生成硫酸钡的反应;
(2)用惰性电极电解Na2S溶液,阳极生成S单质,阴极生成氢气;
(3)往FeBr2溶液中通入过量C12,氯气过量,则二价铁离子、溴离子都被氧化;
(4)FeCl3溶液中撒入CaCO3粉末有气泡产生,实现了沉淀的转化;
(5)氨水吸收少量的二氧化硫,二氧化硫少量,反应生成的是亚硫酸铵;
(6)电解池中,金属铜作阳极时,铜电极本身失去电子,阴极是盐酸中的氢离子放电;
(7)用石墨作电极电解氯化铝溶液生成氢氧化铝、氢气和氯气;
(8)过氧化钠加入到足量H218O中,过氧化钠既做氧化剂又做还原剂,生成的氧气为O2.
解答 解:(1)MgSO4溶液与Ba(OH)2溶液混合,反应生成硫酸钡和氢氧化镁沉淀,正确的反应为:Ba2++SO42-+Mg2++2OH-═Mg(OH)2↓+BaSO4↓,故(1)错误;
(2)用惰性电极电解Na2S溶液,反应生成硫单质、氢气和氢氧化钠,反应的离子方程式为:S2-+2H2O$\frac{\underline{\;电解\;}}{\;}$S↓+H2↑+2OH-,故(2)正确;
(3)往FeBr2溶液中通入过量C12,二价铁离子、溴离子都被氧化,正确的离子方程式为:3Cl2+2Fe2++4Br-═2Fe3++6Cl-+2Br2,故(3)错误;
(4)FeCl3溶液中撒入CaCO3粉末有气泡产生,反应的离子方程式为:2Fe3++3CaCO3+3H2O═2Fe(OH)3↓+3Ca2++3CO2↑,故(4)正确;
(5)氨水吸收少量的二氧化硫,反应生成亚硫酸铵,正确的离子方程式为:2NH3•H2O+SO2═2NH4++SO32-,故(5)错误;
(6)电解池中,金属铜作阳极时,铜电极本身失去电子,阴极是盐酸中的氢离子放电,反应的电解反应为:Cu+2H+$\frac{\underline{\;电解\;}}{\;}$H2↑+Cu2+,故(6)正确;
(7)用石墨作电极电解AlCl3溶液生成氢氧化铝、氢气和氯气,离子方程式:2Al3++6Cl-+6H2O$\frac{\underline{\;电解\;}}{\;}$2Al(OH)3↓+3H2↑+3Cl2↑,故(7)错误;
(8)Na2O2加入到足量H218O中,过氧化钠既做氧化剂又做还原剂,正确的离子方程式为:2Na2O2+2H218O═4Na++418OH-+O2↑,故(8)错误;
根据分析可知,正确的离子方程式有3个,
故选B.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


科目:高中化学 来源:2017届江苏省高三上第一次测试化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A.过氧化钠固体与水反应:2O22-+2H2O=4OH-+O2↑
B.硫酸亚铁溶液中滴加酸化的双氧水:2Fe2++2H++H2O2=2Fe3++2H2O
C.碳酸氢钙溶液中加入足量烧碱溶液:HCO3-+OH-=CO32-+H2O
D.AlCl3溶液中滴加浓氨水至过量:Al3++4NH3·H2O=AlO2—+4NH4++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验方案 | 实验现象 |
| ①将新制氯水滴加到NaBr溶液中,振荡后加入适量CCl4溶液,振荡,静置 | A.浮在水面上,熔成小球,四处游动,随后消失 |
| ②将一小块金属钠放入冷水中 | B.分层,上层无色,下层紫色 |
| ③将溴水滴加到NaI溶液中,振荡后加入适量CCl4溶液,振荡,静置 | C.浮在水面上,熔成小球,四处游动,并伴有轻微的爆炸声,很快消失 |
| ④将一小块金属钾放入冷水中 | D.分层,上层无色,下层红棕色 |
| 实验方案 | 实验现象 | 化学方程式 |
| ① | D | Cl2+2NaBr═2NaCl+Br2 |
| ② | A | 2Na+2H2O═2NaOH+H2↑ |
| ③ | B | Br2+2NaI═2NaBr+I2 |
| ④ | C | 2K+2H2O═2KOH+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 46g乙醇中存在的共价键总数为8NA | |
| B. | 0.5 mol•L-1 CuCl2溶液中含有的Cl-个数为NA | |
| C. | 标准状况下,H2和CO混合气体8.96L在足量O2中充分燃烧消耗O2分子数为0.2NA | |
| D. | 在反应4Cl2+8NaOH═6NaCl+NaClO+NaClO3+4H2O中,消耗1mol Cl2时转移的电子总数为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
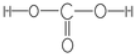 .
.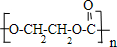 +nH2O.
+nH2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作现象 | 实验结论 |
| A | 向取了少量的KClO3晶体的试管中加入适量的蒸馏水,再向其中加入硝酸酸化的AgNO3溶液 | 该方法可以检验KClO3中是否含有氯元素 |
| B | 向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有 Fe2+ |
| C | 将某气体通入品红溶液中,品红溶液褪色,将褪色溶液加热,品红颜色复原 | 该气体一定是SO2 |
| D | 向AgNO3溶液中加入足量的NaCl溶液,再加入KI溶液,再加入Na2S溶液,先后有白色沉淀变为黄色沉淀,最后又白色变为黑色沉淀 | Ksp(AgCl)>Ksp(AgI)>Ksp(Ag2S) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:选择题
根据下列实验操作和现象所得到的结论正确的是
A.向NaAlO2溶液中通入足量CO2,有白色沉淀产生,说明碳酸的酸性强于氢氧化铝
B.用铂丝蘸取某溶液进行焰色反应,火焰呈黄色,说明溶液中不含有K+
C.在KI淀粉溶液中滴入氯水变蓝,再通入SO2,蓝色褪去,说明SO2具有漂白性
D.向某FeCl2溶液中,加入Na2O2粉末出现红褐色沉淀,说明原FeCl2已氧化变质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com