
下列实验均发生了化学反应:①将铁钉放入CuSO4溶液中;②向FeSO4溶液中
滴加浓HNO3;③将铜丝放入FeCl3溶液中。下列判断中,正确的是
A.上述实验证明了氧化性:Fe3+>Fe2+>Cu2+
B.上述实验证明了Fe3+既有氧化性又有还原性
C.实验①、③中的化学反应都是置换反应
D.向三个实验后的溶液中加入足量NaOH溶液,最终都有Fe(OH)3生成
 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
现代建筑的门窗架常用电解加工成的古铜色硬铝制造。取硬铝样品进行如下实验(每一步试剂均过量),由此可以推知硬铝的组成可能为(提示:Si+2OH-+H2O===SiO +2H2↑) ( )
+2H2↑) ( )

A.Al、Mg、Si、Zn B.Al、Fe、Zn、Na
C.Al、Na、Cu、Fe D.Al、Cu、Mg、Si、Mn
查看答案和解析>>
科目:高中化学 来源: 题型:
某兴趣小组用废铁泥(主要成分为Fe2O3、FeO和少量Fe)制备磁性Fe3O4纳米材料的流程示意图如下:

已知:R=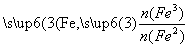 步骤⑤中,相同条件下测得Fe3O4的产率与R的关系如图所示。
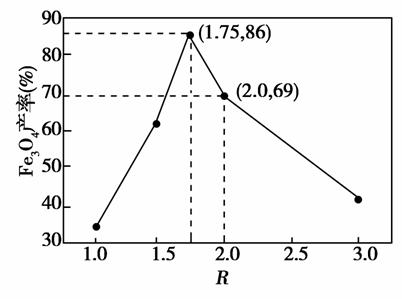
步骤⑤中,相同条件下测得Fe3O4的产率与R的关系如图所示。
(1)步骤②中,主要反应的离子方程式是__________________。
(2)已知:Fe3+在pH=2.8时沉淀完全;Fe2+在pH=6.3时开始沉淀,在pH=8.3时沉淀完全。
步骤③中,用NaOH溶液调pH至9,原因是________________。
(3)浊液D中铁元素以FeOOH形式存在。步骤④中,反应的化学方程式是____________________。
(4)下列说法正确的是________(选填字母)。
a.步骤④中,当反应完成后需再加热一段时间
b.步骤⑤中,反应过程中需要不断补充碱液
c.步骤⑤恰好反应时, =2:1
=2:1
d.当 =
= 时,Fe3O4的产率最高
时,Fe3O4的产率最高
查看答案和解析>>
科目:高中化学 来源: 题型:
随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保
质期,防止食品氧化变质,在包装袋中可以放入的化学物质是
 A.无水硫酸铜 B.硫酸亚铁 C. 食盐 D. 生石灰
A.无水硫酸铜 B.硫酸亚铁 C. 食盐 D. 生石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C为短周期元素,A元素原子最外层只有一个电子,B元素原子最外层有四个电子,C元素L层中有六个电子,这三种元素组成的化合物其化学式 可能是
可能是
A.A2BC4 B.A2B2C4 C.A2BC3 D. A4BC4
查看答案和解析>>
科目:高中化学 来源: 题型:
医学上常用酸性高锰酸钾溶液和草酸溶液的反应用于测定血钙的含
量。回答下列问题:
 ___H+ + ___MnO4- + ___H2C2O4 → ___CO2↑+___Mn2+ +____ ( )
___H+ + ___MnO4- + ___H2C2O4 → ___CO2↑+___Mn2+ +____ ( )
 (1).配平以上离子方程式,并在 ( ) 中填上所需的微粒。
(1).配平以上离子方程式,并在 ( ) 中填上所需的微粒。
 (2).该反应中的还原剂是
(2).该反应中的还原剂是
 (3).反应转移了0.4mol电子,则消耗KMnO4的物质的量为 mol。
(3).反应转移了0.4mol电子,则消耗KMnO4的物质的量为 mol。
 (4).测定血钙的含量的方法是:取2mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解得到H2C2O4后,再用KMnO4溶液滴定。
(4).测定血钙的含量的方法是:取2mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解得到H2C2O4后,再用KMnO4溶液滴定。
 ①稀硫酸溶解CaC2O4沉淀的化学方程式是
①稀硫酸溶解CaC2O4沉淀的化学方程式是
 ②溶解沉淀时 (能或不能)用浓盐酸,原因是
②溶解沉淀时 (能或不能)用浓盐酸,原因是
 ③若消耗了1.0×10-4mol/L的KMnO4溶液20.00mL,则100mL该血液中含钙 g
③若消耗了1.0×10-4mol/L的KMnO4溶液20.00mL,则100mL该血液中含钙 g
查看答案和解析>>
科目:高中化学 来源: 题型:
如下图所示,△H1=-393.5 kJ?mol-1,
△H2=-395.4 kJ?mol-1,下列说法或表示式正确的是
A. C(s、石墨)== C(s、金刚石) △H= - 1.9 kJ?mol-1
B. 石墨和金刚石的转化是物理变化
C. 石墨的稳定性强于金刚石
D. 1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ

查看答案和解析>>
科目:高中化学 来源: 题型:
氮化硅(Si3N4)是一种优良的高温结构陶瓷,在工业生产和科技领域中有重要用途。
Ⅰ.工业上有多种方法来制备氮化硅,下面是几种常见的方法:
方法一 直接氮化法:在1 300~1 400 ℃时,高纯粉状硅与纯氮气化合,其反应方程式为________________________________________________________________________。
方法二 化学气相沉积法:在高温条件下利用四氯化硅气体、纯氮气、氢气反应生成氮化硅和HCl,与方法一相比,用此法制得的氮化硅纯度较高,其原因是________________________________________________________________________。
方法三 Si(NH2)4热分解法:先用四氯化硅与氨气反应生成Si(NH2)4和一种气体________________(填分子式);然后使Si(NH2)4受热分解,分解后的另一种产物的分子式为____________________。
Ⅱ.(1)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,此盐中存在的化学键类型有______________。
(2)已知:25 ℃,101 kPa条件下的热化学方程式:
3Si(s)+2N2(g)===Si3N4(s) ΔH=-750.2 kJ·mol-1①
Si(s)+2Cl2(g)===SiCl4(g) ΔH=-609.6 kJ·mol-1②
 H2(g)+
H2(g)+ Cl2(g)===HCl(g) ΔH=-92.3 kJ·mol-1③
Cl2(g)===HCl(g) ΔH=-92.3 kJ·mol-1③
请写出四氯化硅气体与氮气、氢气反应的热化学方程式:
________________________________________________________________________。
Ⅲ.工业上制取高纯硅和四氯化硅的生产流程如下:

已知:X、高纯硅、原料B的主要成分都可与Z反应,Y与X在光照或点燃条件下可反应,Z的焰色呈黄色。
(1)原料B的主要成分是________(写名称)。
(2)写出焦炭与原料B中的主要成分反应的化学方程式:
________________________________________________________________________。
(3)上述生产流程中电解A的水溶液时,阳极材料能否用Cu?________(填“能”或“不能”)。写出Cu为阳极电解A的水溶液开始一段时间阴、阳极的电极方程式。
阳极:________;阴极________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com