
【题目】已知下列反应的反应热: (1.)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=﹣870.3kJmol﹣1
(2.)C(s)+O2(g)═CO2(g)△H2=﹣393.5kJmol﹣1
(3.)H2(g)+ ![]() O2(g)═H2O(l)△H3=﹣285.8kJmol﹣1
O2(g)═H2O(l)△H3=﹣285.8kJmol﹣1
则下列反应的反应热为( )
2C(s)+2H2(g)+O2(g)═CH3COOH(l)
A.△H=+488.3 kJmol﹣1
B.△H=﹣244.15 kJmol﹣1
C.△H=﹣977.6 kJmol﹣1
D.△H=﹣488.3 kJmol﹣1
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中正确的是( ) 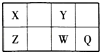
A.钠与W可能形成Na2W2化合物
B.由Z与Y组成的物质在熔融时能导电
C.W得电子能力比Q强
D.X有多种同素异形体,而Y不存在同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个温度恒定且容积保持不变的容器中进行着如下反应:H2(g)+I2(g)2HI(g),能说明该反应已达到平衡状态的是( )
A.容器内 ![]()
B.容器内的压强不再变化
C.断裂1mol H﹣H的同时生成2mol H﹣I
D.容器内颜色不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,关于溶液的稀释说法正确的是( )
A.将1 L 0.1molL﹣1的Ba(OH)2溶液加水稀释为2L,pH=13
B.pH=3的醋酸溶液加水稀释100倍,pH=5
C.pH=4的H2SO4加水稀释100倍,溶液中由水电离产生的[H+]=1×10﹣6molL﹣1
D.pH=8的NaOH溶液加水稀释100倍,其pH=6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(又称肼,N2H4 , 无色液体)是一种应用广泛的化工原料,可用作火箭燃料.回答下列问题:
(1)联氨分子的电子式为 , 其中氮的化合价为 .
(2)实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为 .
(3)①2O2(g)+N2(g)═N2O4(l)△H1
②N2(g)+2H2(g)═N2H4(l)△H2
③O2(g)+2H2(g)═2H2O(g)△H3
④2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H4=﹣1048.9kJmol﹣1
上述反应热效应之间的关系式为△H4= , 联氨和N2O4可作为火箭推进剂的主要原因为 .
(4)联氨为二元弱碱,在水中的电离方式与氨相似.联氨第一步电离反应的平衡常数值为(已知:N2H4+H+N2H5+的K=8.7×107;Kw=1.0×10﹣14).联氨与硫酸形成的酸式盐的化学式为 .
(5)联氨是一种常用的还原剂.向装有少量AgBr的试管中加入联氨溶液,观察到的现象是 . 联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀.理论上1kg的联氨可除去水中溶解的O2kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试液中只可能含有下列K+、NH4+、Fe2+、Al3+、Cl﹣、SO42﹣、CO32﹣、AlO2﹣ 中的若干种离子,离子浓度均为0.1molL﹣1 . 某同学进行了如图实验: 
(1)根据实验现象判断,滤液X中大量存在的阳离子有;
(2)沉淀A的化学式;沉淀B的化学式;
(3)沉淀C的成分(填“能”或“不能”)确定.若能确定,写出化学式;若不能,说明理由 .
(4)该溶液中一定存在的离子是;一定不存在的离子是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A元素原子的L层比B元素原子的L层少3个电子,B元素原子核外电子数比A元素原子核外电子总数多5个,则A,B两元素形成的化合物可表示为( )
A.BA2
B.BA3
C.A3B2
D.B3A2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是中学教材中元素周期表的一部分,其中标出A~Q14种元素,试回答下列问题: 
(1)在上表所列出的短周期元素中(填具体物质化学式) 原子半径最小的是(除稀有气体元素);阴离子还原性最弱的是;最高价氧化物对应的水化物中酸性最强的是 .
(2)F和G两元素相比较,金属性较强的是(填名称),可以验证该结论的实验是 . (填编号) a.将在空气中放置已久的这两种元素的块状单质分别放入热水中
b.将这两种元素的单质粉末分别和同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
(3)B元素形成的单质的结构式为 , E2C2的电子式为 .
(4)写出E的最高价氧化物对应的水化物与G单质发生的反应的离子方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定的条件下,下列选项所示的物质间转化均能实现的是( )
A.SiO2 ![]() SiCl4
SiCl4 ![]() Si
Si
B.FeS2 ![]() SO2
SO2 ![]() H2SO4
H2SO4
C.N2 ![]() NH3
NH3 ![]() NH4Cl(aq)
NH4Cl(aq)
D.MgCO3 ![]() MgCl2(aq)
MgCl2(aq) ![]() Mg
Mg
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com