
【题目】设NA代表阿伏加德罗常数的值,下列叙述正确的是
A. 常温常压下,22. 4 L乙烷和乙烯含碳原子数为2NA
B. 室温下,42.0 g乙烯含C—H键为3NA
C. 标准状况下,2.24 L甲烷和乙烯混合气体中含氢原子数为0.4NA
D. 标准状况下,22.4 L苯所含的分子数为NA
【答案】C
【解析】A.常温常压,Vm≠22.4L/mol;B.质量和微粒数目之间的关系式:N=nNA=![]() NA,1个C2H4含有的C—H数为4个,据此解答;C.1个CH4和1个C2H4分子均含有4个氢原子;
NA,1个C2H4含有的C—H数为4个,据此解答;C.1个CH4和1个C2H4分子均含有4个氢原子;
D.气体摩尔体积适应对象为气体。
A.常温常压,Vm≠22.4L/mol,无法计算乙烷和乙烯的物质的量,故A错误;
B.42.0 g乙烯的物质的量为![]() =1.5mol,含有的含C—H键数为6NA,所以B选项是错误的;
=1.5mol,含有的含C—H键数为6NA,所以B选项是错误的;
C.标准状况下,22.4L甲烷和乙烯物质的量为![]() =0.1mol,所含氢原子数为0.4NA,故C正确;
=0.1mol,所含氢原子数为0.4NA,故C正确;
D.标况下,苯为液体,不能使用气体摩尔体积,故D错误;
所以C选项是正确的。


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
【题目】合成氨是工业上的重要反应:N2(g)+3H2(g)![]() 2NH3(g),下列说法不正确的是
2NH3(g),下列说法不正确的是
A. 反应达平衡状态后,各物质浓度不变,反应停止
B. 反应达平衡状态后,单位时间内生成1mol N2的同时消耗3mol H2
C. 在上述条件下,N2不可能100%转化为NH3
D. 使用催化剂是为了加快反应速率,提高生产效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中A与B反应生成C,其反应速率分别用v(A),v(B),v(C)表示,已知v(A),v(B),v(C)之间有以下关系3v(A)=2v(B),3v(C)=2v(B),则此反应可表示为( )
A.2A+3B=2C
B.A+3B=2C
C.3A+B=2C
D.A+B=C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废铅蓄电池的铅泥(PbO、Pb及PbSO4等)可制备精细无机化工产品“三盐”(3PbO·PbSO4·H2O),主要制备流程如下:

(1)步骤①PbSO4转化为难溶PbCO3的离子方程式为 ____________________________。
(2)滤液1和滤液3经脱色、蒸发、结晶可得到的副产品为____________(写化学式)。
(3)步骤③酸溶时,其中的铅与硝酸生成Pb(NO3)2及NO的离子方程式为____________________________;滤液2中溶质主要成分为________(写化学式)。
(4)步骤⑥合成三盐的化学方程式为 _______________________________________。
(5)步骤⑦洗涤操作时,检验沉淀是否洗涤干净的方法是 ___________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物分子中,当某个碳原子连接着四个不同的原子或原子团时,这种碳原子称为“手性碳原子”.例如,如图有机物分子中带“*”碳原子就是手性碳原子.该有机物分别发生下列应,生成的有机物分子中仍含有手性碳原子的是( ) 
A.发生银镜反应
B.与NaOH水溶液反应
C.催化剂作用下与H2反应
D.与乙酸发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的 ( )
实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
V/mL | c/(molL﹣1) | V/mL | c/(molL﹣1) | V/mL | ||
A | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定质量的下列各组物质混合后,无论以何种比例混合,其充分燃烧后一定能得到相同物质的量的二氧化碳和水的是
A.C2H4 C4H8B.CH4 C3H8C.C3H6 C3H8D.C2H2 C2H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】牡丹为中国的传统名花,有"花中之王"、"国色天香"之美誉。其花瓣细胞中,组成核酸的碱基、五碳糖、核苷酸的种类数分别是 ( )
A.5、2、8 B.4、2、2 C.5、2、2 D.4、4、8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、某实验小组同学探究铜与硝酸的反应。
(1)用浓硝酸和水按照不同体积比配成不同浓度的硝酸溶液,各取10 mL硝酸溶液分别与铜片反应,实验记录如下:
序号 | 浓硝酸与水的体积比 | 实验现象 |
Ⅰ | 1:1 | 反应速率快,溶液很快变成绿色,铜丝表面有大量气泡冒出,气体呈红棕色 |
Ⅱ | 1:3 | 反应速率较快,溶液变成蓝色,铜丝表面有大量气泡冒出,气体无色 |
Ⅲ | 1:5 | 反应速率慢,微热后速率加快,溶液变成蓝色,铜丝表面有气泡冒出,气体无色 |
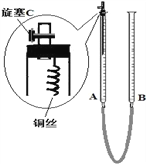
①铜与稀硝酸反应的离子方程式为_______________________________________;
②依据上表,制备NO气体最适宜的是实验II,理由是__________________________
(2)为防止有毒气体逸散造成空气污染,该小组同学改进实验装置,如右图所示(夹持仪器略去)。用该装置进行铜与稀硝酸的反应并验证产生NO气体的性质,实验步骤如下:
Ⅰ.安装好装置后,检查装置气密性。
Ⅱ.打开旋塞C,从B管上端加入所选浓度的硝酸,至铜丝下沿(不接触铜丝)。
Ⅲ.向上移动B管,使A管液面上升至与橡皮塞恰好接触,关闭旋塞C,反应开始。
Ⅳ.当液面重新下降至与铜丝脱离接触时,反应停止。
Ⅴ.打开旋塞C,向下移动B管,使A中迅速进入少量空气,关闭旋塞C,观察现象。
①步骤Ⅰ中检查装置气密性的操作是:关闭旋塞C,从B管上端加入水,若观察到______________________________,说明装置的气密性良好。
②步骤Ⅲ操作的目的是________________________________________。
③步骤Ⅴ产生现象之后的化学反应离子方程式:_____________________________
Ⅱ、(3)高氯酸铵可用作火箭推进剂,已知:2NH4ClO4 ![]() N2↑+2O2↑+Cl2↑+4H2O。现可提供下列试剂:a.饱和食盐水 b.浓H2SO4 c.NaOH溶液 d.Mg e.Cu f.Fe
N2↑+2O2↑+Cl2↑+4H2O。现可提供下列试剂:a.饱和食盐水 b.浓H2SO4 c.NaOH溶液 d.Mg e.Cu f.Fe
利用下图装置对高氯酸铵受热分解产生的三种气体分别进行吸收或收集。
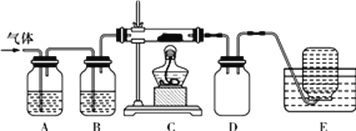
①E中收集到的气体可能是_______________(填化学式);
②A、B、C中盛放的药品依次可以是______________(填“Ⅰ”“Ⅱ”或“Ⅲ”)。
Ⅰ.a、b、c Ⅱ.c、b、e Ⅲ.b、c、f
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com