
【题目】某化学小组以苯甲酸为原料,制取苯甲酸甲酯,已知有关物质的沸点如表:
物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
沸点/℃ | 64.7 | 249 | 199.6 |
(1)合成苯甲酸甲酯粗产品 (i)甲和乙两位同学分别设计了如图所示的两套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去).根据有机物的沸点,最好采用(填“甲”或“乙”)装置.理由是 . 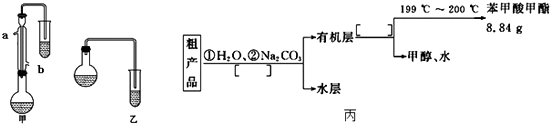
(ii)实验中浓硫酸的作用是冷凝水应从(填“a”或“b”,下同)口进,口出.
(iii)反应物CH3OH应过量,理由是;两套装置中导管末端均没有伸入到试管液面以下的原因 .
(2)粗产品的精制 苯甲酸甲酯粗产品中往往含有少量甲醇、苯甲酸和水等,现拟用下列流程图进行精制,请在流程图丙中方括号内填入操作方法的名称.
【答案】
(1)甲;甲中有冷凝回流装置;催化剂、吸水剂;b;a;为了提高苯甲酸甲酯的产率;防止倒吸
(2)分液|蒸馏
【解析】解:(1)(i)由装置图可知,甲图的圆底烧瓶上有冷凝管,充分起到回流作用,乙图没有,而本题中反应物甲醇沸点低,苯甲酸、苯甲酸甲酯的沸点远高于甲醇,若采用乙图,甲醇必定会大量挥发,不利于合成反应,所以应冷凝回流,减少甲醇的挥发,提高产率;所以答案是:甲; 甲中有冷凝回流装置;(ii)浓硫酸在酯化反应中起到了催化剂作用,酯化反应为可逆反应,浓硫酸吸收反应生成的水,可以促进酯的生成,浓硫酸起到了吸水剂的作用;冷凝管中采用逆向通水,冷凝效果较好,则冷凝水应该从b口进水,从a口出水,所以答案是:催化剂、吸水剂; b;a;(iii)该反应中,反应物CH3OH应过量,可使平衡向着正向移动,有利于提高苯甲酸甲酯的产率苯甲酸和甲醇都易溶于水,制取的苯甲酸甲酯中混有苯甲酸和甲醇,若导管伸入溶液中,会发生倒吸现象,所以两套装置中导管末端均没有伸入到试管液面以下的目的是防止倒吸,所以答案是:为了提高苯甲酸甲酯的产率; 防止倒吸;(2)根据流程图可知,粗产品中含有甲醇和苯甲酸,加入水和碳酸钠可以溶解甲醇、除去苯甲酸,由于苯甲酸甲酯不溶于水,则分离出苯甲酸甲酯和水溶液的方法为分液;甲醇和苯甲酸甲酯相互溶解,二者沸点不同,可以通过蒸馏操作分离,所以答案是:分液;蒸馏.


科目:高中化学 来源: 题型:
【题目】将适量铁粉放入三氯化铁溶液中,完全反应后,溶液中的Fe2+和Fe3+的物质的量浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是
A. 2︰3 B. 3︰2 C. 1︰2 D. 1︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浅绿色的Fe (NO3)2溶液中逐滴加入少量的稀硫酸时,溶液的颜色变化应该是
A. 颜色变浅 B. 变为血红色 C. 没有改变 D. 变为黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( ) 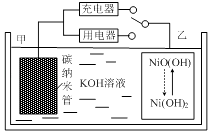
A.放电时,甲电极为正极,OH﹣移向乙电极
B.放电时,乙电极反应为:NiO(OH)+H2O+e﹣=Ni(OH)2+OH﹣
C.充电时,电池的碳电极与直流电源的正极相连
D.电池总反应为H2+2NiOOH ![]() 2Ni(OH)2
2Ni(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图图示与对应的叙述相符的是( ) 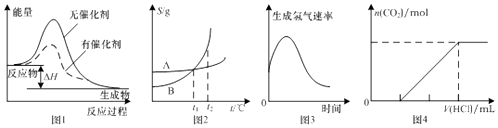
A.图1表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示A,B两物质的溶解度随温度变化情况,将t1℃时A,B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
C.图3表示镁条放入盐酸中生成氢气速率随时间的变化,起初反应速率加快的原因可能是该反应为放热反应
D.图4表示在含等物质的量NaOH,Na2CO3的混合溶液中滴加0.1 molL﹣1盐酸至过量时,产生气体的体积与消耗盐酸的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产生活中有着重要的应用.请按要求写出相应的方程式.
(1)将含SO2的废气通入含Fe2+(催化剂)的溶液中,常温下可使SO2转化为SO24﹣ , 其总反应为2SO2+O2+2H2O=2H2SO4 . 上述总反应分两步进行,第一步反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,写出第二步反应的离子方程式: .
(2)pH=3.6时,碳酸钙与硫酸铝反应可制备碱式硫酸铝[Al2(SO4)x(OH)6﹣2x]溶液.若溶液的pH偏高,则碱式硫酸铝产率降低且有气泡产生,用化学方程式表示其原因: .
(3)ClO2是一种高效安全的杀菌消毒剂.氯化钠电解法生产ClO2工艺原理示意图如下: 
①写出氯化钠电解槽内发生反应的离子方程式: .
②写出ClO2发生器中的化学方程式,并标出电子转移的方向及数目: .
③ClO2能将电镀废水中的CN﹣离子氧化成两种无毒气体,自身被还原成Cl﹣ . 写出该反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A.手性催化剂主要催化一种手性分子的合成
B.原子晶体的熔点一定比金属晶体的高
C.元素电负性越大的原子,吸引电子的能力越强
D.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析实验中出现下列现象对所配溶液的浓度有何影响:
(1)①浓硫酸溶解后未冷却至室温即转移至容量瓶中进行定容,(填“偏高”、“偏低”或“无影响”);
②定容时仰视刻度线,;填“偏高”、“偏低”或“无影响”);
③量取好浓硫酸倒入烧杯溶解后,用水洗涤量筒2~3次,将洗涤液倒入烧杯中, . (填“偏高”、“偏低”或“无影响”);
(2)7.8g镁铝合金与足量的稀盐酸反应,生成氢气的体积为8.96L(标准状况),则此反应中转移电子的数目为 , 镁和铝分别产生氢气的体积之比为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com