
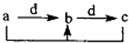
 如表各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
如表各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )物质 选项 | a | b | c | d |
| A | Al | Al(OH)3 | NaAlO2 | NaOH |
| B | N2 | NO | NO2 | O2 |
| C | Na2CO3 | NaHCO3 | NaOH | CO2 |
| D | Cl2 | FeCl3 | FeCl2 | Fe |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Al和NaOH生成NaAlO2而不是Al(OH)3;
B.N2和O2反应生成一氧化氮,一氧化氮与氧气反应生成二氧化氮,但氮气与二氧化氮不反应;
C.NaHCO3与CO2不反应;
C.Cl2和Fe反应生成FeCl3,FeCl3与Fe反应生成FeCl2,Cl2与FeCl2反应生成FeCl3.
解答 解:A.Al和NaOH生成NaAlO2而不是Al(OH)3,如a为AlCl3可符合,故A错误;
B.N2和O2反应生成一氧化氮,一氧化氮与氧气反应生成二氧化氮,但氮气与二氧化氮不反应,故B错误;
C.NaHCO3与CO2不反应,故C错误;
D.Cl2和Fe反应生成FeCl3,FeCl3与Fe反应生成FeCl2,Cl2与FeCl2反应生成FeCl3,符合转化关系,故D正确.
故选D.
点评 本题考查无机物的推断,题目侧重于元素化合物的考查,注意把握相关物质的性质,题目难度不大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的分馏产物主要成分是碳氢化合物 | |
| B. | 工业上可通过石油的裂解获得大量乙烯 | |
| C. | 重油经过裂化可以得到汽油 | |
| D. | 煤中含有苯、甲苯,可用分馏的方法将它们分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇结构中有-OH,所以乙醇溶解于水,可以电离出OH-而显碱性 | |
| B. | 乙醇与乙酸反应生成乙酸乙酯,所以乙醇显碱性 | |
| C. | 乙醇与钠反应可以产生氢气,所以乙醇显酸性 | |
| D. | 乙醇与钠反应非常平缓,所以乙醇羟基上的氢原子不如水中的氢原子活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
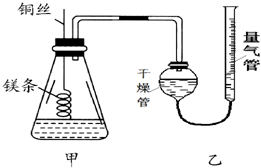 某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答以下问题.该小组设计的简易实验装置如图所示:
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答以下问题.该小组设计的简易实验装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L苯中含有的分子数目为NA | |
| B. | 25℃、101 kPa时,20 g SO3中含有的原子数目为NA | |
| C. | 1 L 1 mol•L-1 MgCl2溶液中含有的氯离子数目为NA | |
| D. | 16.8 g Fe与足量水蒸气反应,转移的电子数目为0.9NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com