
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源:不详 题型:实验题
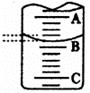
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.32 | 25.34 | 25.30 |
| A.滴定前滴定管尖嘴有气泡,滴定结束无气泡 |
| B.盛装标准液的滴定管装液前用蒸馏水洗后,未用标准液润洗 |
| C.第一次滴定用的锥形瓶用白醋润洗 |
D.该NaOH标准液保存时间过长,有部分变质,浓 度降低 度降低 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.滴定管“0”刻度在滴定管的上端 |
| B.先将pH试纸用蒸馏水润湿后,再测定溶液的pH |
| C.测定中和热时,为了减少热量损失,不要搅拌溶液 |
| D.配制稀硫酸时,先在量筒中加一定体积的水,再边搅拌边慢慢加入浓硫酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
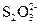 ====2I-+
====2I-+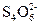 来测定I2的量,从而可以求出氧化性离子的浓度。
来测定I2的量,从而可以求出氧化性离子的浓度。| A.酚酞溶液 |
| B.KMnO4酸性溶液 |
| C.淀粉溶液 |
| D.甲基橙溶液 |
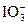 也可以与I-发生如下反应:5I-+
也可以与I-发生如下反应:5I-+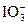 +6H+====3I2+3H2O,某学生取Cu(IO3)2饱和溶液100 mL,加入足量酸化的KI溶液,用0.11 mol·L-1的Na2S2O3溶液进行滴定,消耗了Na2S2O3溶液35.30 mL,有关系式Cu(IO3)2~6.5I2,则Cu(IO3)2溶液的物质的量浓度为__________mol·L-1。
+6H+====3I2+3H2O,某学生取Cu(IO3)2饱和溶液100 mL,加入足量酸化的KI溶液,用0.11 mol·L-1的Na2S2O3溶液进行滴定,消耗了Na2S2O3溶液35.30 mL,有关系式Cu(IO3)2~6.5I2,则Cu(IO3)2溶液的物质的量浓度为__________mol·L-1。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
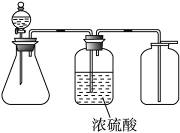
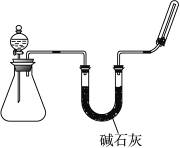
| A | 二氧化锰和浓盐酸 | 应选用图1装置 |
| B | 浓盐酸和浓硫酸 | 图1和图2装置均不能选用 |
| C | 生石灰和浓氨水 | 应选用图2装置 |
| D | 过氧化钠和水 | 应选用图2装置 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.两个电极都可选用Fe片 |
| B.电源电极接反时仍能产生一定净水效果 |
| C.反应中产生的H2会将Fe3+还原成Fe2+ |
| D.电浮选凝聚法用于工业污水处理时要注意通风,防止爆炸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.从试剂瓶中取出的任何药品,若有剩余不能再放回原试剂瓶 |
| B.用稀盐酸洗涤盛放过石灰水的试剂瓶 |
| C.配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 |
| D.各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com