
| �� �� | 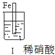 | 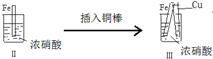 | |
| �� �� | ���������������ɫ���ݣ�Һ���Ϸ���Ϊ����ɫ | �����������������ɫ���ݺ�Ѹ��ֹͣ | ����ͭ�Ӵ�����������������ɫ���� |
| A�� | ������������ɫ�����ɫ�Ļ�ѧ����ʽΪ��2NO+O2��2NO2 | |
| B�� | ���е�����˵��Fe�����γ����ܵ������㣬��ֹFe��һ����Ӧ | |
| C�� | �ԱȢ�������˵��ϡHNO3��������ǿ��ŨHNO3 | |
| D�� | ���III��������Fe��Cu֮�����ӵ����ƣ����ж�Fe�Ƿ���������� |
���� A���������ǿ�����ԣ���Fe��Ӧ����NO��NO��������Ϊ����������
B��Ũ�������ǿ�����ԣ�Fe�����γ����ܵ������㣬�����ۻ�����
C���Ա�I���������Fe��ϡ���ᷴӦ����NO����Fe��Ũ���ᷴӦ���ɶ���������Ѹ�ٱ��ۻ���˵��Ũ�����������ǿ��ϡ���
D�����ݢ�������˵������ԭ��أ���Fe��Cu֮�����ӵ����ƣ�ͨ��������ָ��ƫת�������ж�ԭ��ص���������
��� �⣺A��ϡ�������������ǿ�����ԣ���Fe��Ӧ����NO��NO��������Ϊ����������������������ɫ�����ɫ�Ļ�ѧ����ʽ��2NO+O2�T2NO2����A��ȷ��
B�������������Ϊ�������˶ۻ���Fe�����γ����ܵ������㣬��ֹFe��һ����Ӧ����B��ȷ��
C���Ա�I���������Fe��ϡ���ᷴӦ����NO����Fe��Ũ���ᷴӦ���ɶ���������Ѹ�ٱ��ۻ���˵��Ũ�����������ǿ��ϡ���ᣬ��C����
D�����ݢ�������˵������ԭ��أ���Fe��Cu֮�����ӵ����ƣ�ͨ��������ָ��ƫת�������ж�ԭ��ص��������������ж�Fe�Ƿ���������D��ȷ��
��ѡC��
���� ���⿼������Ļ�ѧ���ʡ�ԭ���ԭ����Ϊ��Ƶ���㣬�ѶȲ����ؿ���ѧ��������������������ע�������������ʣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
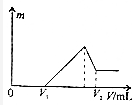 ��0.1mol��þ�������������100mL2mol/LH2SO4��Һ�У�Ȼ���ٵμ�1mol/LNaOH��Һ�����ڵμ�NaOH��Һ�Ĺ����У���������m�����NaOH��Һ�����V�仯��ͼ��ʾ����V2=460mLʱ����ԭ�������þ�����������ǣ�������
��0.1mol��þ�������������100mL2mol/LH2SO4��Һ�У�Ȼ���ٵμ�1mol/LNaOH��Һ�����ڵμ�NaOH��Һ�Ĺ����У���������m�����NaOH��Һ�����V�仯��ͼ��ʾ����V2=460mLʱ����ԭ�������þ�����������ǣ�������| A�� | 1��1 | B�� | 2��3 | C�� | 16��27 | D�� | 8��9 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.1mol �Ա��������к���˫������ĿΪ0.2NA | |
| B�� | ��״���£�11.2 L��ȩ�����ĦҼ���ĿΪ2NA | |
| C�� | 2mol NO��1mol O2��ϣ����ܱ������г�ַ�Ӧ�������ڵķ���������2NA | |
| D�� | 1mol Fe �����������ᷴӦ��ת�Ƶĵ�����Ϊ0.2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
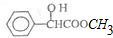
| A�� | ����ʽΪC9H10O3 | |
| B�� | ���Է���ȡ����Ӧ���ӳɷ�Ӧ��������Ӧ�ͻ�ԭ��Ӧ | |
| C�� | 1mol������������4mol H2�����ӳɷ�Ӧ | |
| D�� | �䱽���ϵĶ��ȴ��ﹲ�����ֽṹ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ��g����H=-106kJ•mol-1
��g����H=-106kJ•mol-1 +AgO ��
+AgO ��| A�� | ��Ӧ�Ļ�ܵ���106kJ•mol-1 | |
| B�� | AgO2Ҳ�Ƿ�Ӧ�Ĵ��� | |
| C�� | ������ϩŨ�������������������������� | |
| D�� | ������0.7mol��ϩ���뷴Ӧ���ɵõ�0.6mol�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
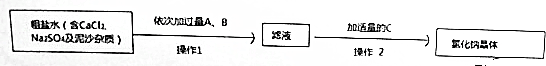
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��pH��Ϊa������������Һ�Ͱ�ˮ�ֱ��ˮϡ��100����pH��Ϊb��c����a��b��c�Ĵ�С��ϵ�ǣ�b��c��a | |
| B�� | ������5.0��10-3mol•L-1KHA��Һ��pH=3.75������Һ��c��A2-����c��H2A�� | |
| C�� | a mol/L��HCN��Һ��b mol/L��NaOH��Һ�������ϣ�������Һ��c��Na+����c��CN-������aһ��С��b | |
| D�� | Na2C2O4��Һ��c��OH-��=c��H+��+c��HC2O4-��+2c��H2C2O4�� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com