
| A. | 硒化氢很稳定 | |
| B. | 硒化氢的水溶液显弱酸性 | |
| C. | 非金属性比硫弱 | |
| D. | 其最高价氧化物的水化物酸性强于砷弱于溴 |
分析 根据Se位于元素周期表中的第四周期第ⅥA族,硒与氧、硫同主族,性质与S类似,非金属性O>S>Se,非金属性越强,其氢化物越稳定,最高价氧化物的水化物的酸性越强,并利用类推法来解答.
解答 解:A.非金属性:S>Se,氢化物的稳定性:H2S>H2Se,则硒的氢化物H2Se不稳定,故A错误;
B、H2Se与H2S性质类似,H2S的水溶液显弱酸性,则硒化氢的水溶液显弱酸性,故B正确;
C、同主族从上往下非金属性减弱,所以Se非金属性比硫弱,故C正确;
D、非金属性Br>Se>As,则最高价氧化物的水化物的酸性HBrO4>H2SeO4>H3AsO4,故D正确;
故选A.
点评 本题考查学生利用元素周期律来解答,明确同主族元素性质的相似性和递变性是解答本题的关键,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ca2+、N03-、C032- | B. | Ba2+、K+、HC03-、Al02- | ||
| C. | Na+、NH4+、Cl0-、0H- | D. | Mg2+Al3+、Cl-、S042- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| B. | 乙醇和乙酸都是常用调味品的主要成分,它们在一定条件下都可以发生取代反应 | |
| C. | 分子式为C4H9Cl的同分异构体共有4种(不考虑立体异构) | |
| D. | 除去乙醇中少量的乙酸:加足量生石灰,蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图A 直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空
如图A 直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空查看答案和解析>>
科目:高中化学 来源: 题型:多选题
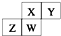 如图为元素周期表截取的短周期的一部分,四种元素均不是稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
如图为元素周期表截取的短周期的一部分,四种元素均不是稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 气态氢化物的稳定性:Z>W>X>Y | |
| C. | z的最高正化合价与最低负化合价的绝对值可能相等 | |
| D. | w的最高价氧化物的水化物可能为弱酸,也有可能为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaO2、NaCl、LiH 三种物质阳离子与阴离子个数比均为:1:1 | |
| B. | CCl4、NH3、PCl3中所有原子都满足最外层为8电子结构 | |
| C. | 甲烷可与溴水发生取代反应,乙烯可与溴水发生加成反应 | |
| D. | 燃料电池是通过燃烧所释放的热能再转化为电能的装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
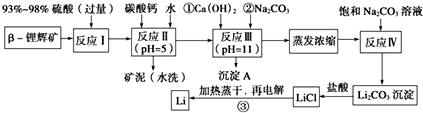
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com