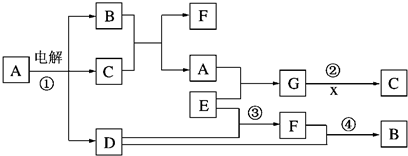
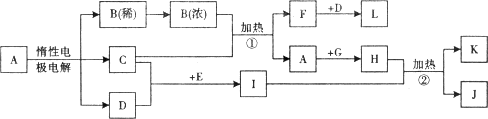
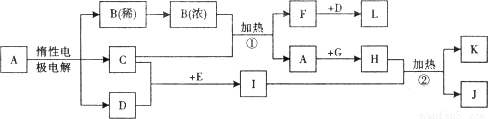
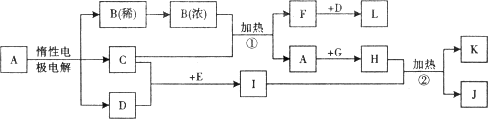
解:I的溶液常用于浸制生物标本,应为甲醛的水溶液,则E为CH
3OH,在加热条件下与CuO反应生成甲醛,所以C为Cu,D为氧气,在常温下为无色气体,根据C与B的浓溶液反应可知A为
CuSO
4,B为H
2SO
4,F为SO
2,L为SO
3,根据甲醛与新制备氢氧化铜浊液反应可知,H为Cu(OH)
2,K为Cu
2O,L为HCOOH,
(1)由以上推断可知A为CuSO
4,故答案为:CuSO
4;
(2)电解CuSO
4溶液时,OH
-离子在阳极放电被氧化生成氧气,电极反应为4OH
--4e
-=O
2↑+2H
2O,
故答案为:4OH
--4e
-=O
2↑+2H
2O;
(3)工业上,反应F+D→L为工业制硫酸的反应,在接触室中SO
2与O
2在催化剂的条件下生成SO
3,反应在400~500
0C常压时,SO
2与O
2在接触室中反应转化率已经很高了,无需增大压强,并且400~500
0C时,该反应催化剂活性最高.
故答案为:接触室;400~500
0C常压时,SO
2与O
2在接触室中反应转化率已经很高了;400~500
0C时,该反应催化剂活性最高,反应速率快,有利于提高产量;
(4)浓硫酸具有强氧化性,在加热条件下与Cu反应,方程式为Cu+2H
2SO
4(浓)

CuSO
4+SO
2↑+2H
2O,
故答案为:Cu+2H
2SO
4(浓)

CuSO
4+SO
2↑+2H
2O;
(5)甲醇具有还原性,在原电池中做负极被氧化,电极反应式为CH
3OH-6e
-+8OH
-=CO
32-+6H
2O,故答案为:CH
3OH-6e
-+8OH
-=CO
32-+6H
2O.
分析:I的溶液常用于浸制生物标本,应为甲醛的水溶液,则E为CH
3OH,在加热条件下与CuO反应生成甲醛,所以C为Cu,D为氧气,在常温下为无色气体,根据C与B的浓溶液反应可知A为CuSO
4,B为H
2SO
4,F为SO
2,L为SO
3,根据甲醛与新制备氢氧化铜浊液反应可知,H为Cu(OH)
2,K为Cu
2O,L为HCOOH,以此解答题中各问.
点评:本题考查无机物的推断,题目较为综合,涉及电化学知识以及工业制硫酸等知识,正确推断框图中各物质为解答该题的关键.

 CuSO4+SO2↑+2H2O,
CuSO4+SO2↑+2H2O, CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;