
在标准状况下,10L有H2、CO2、CO、N2组成的混合气体中,再通入6.0LO2,使之燃烧后,测得同温同压下气体体积为7.5L,将这些气体通过盛有NaOH的洗气瓶,其体积变为2.0L,该2.0L气体在标准状况下是氢气密度的15.5倍,计算原混合气体中各种体积的体积及CO的质量.
|
解析:通入O2后,发生反应方程式为:2H2+O2 V(CO)+V(CO2)=7.5L-2L=5.5L ① 剩下的2L气体的平均摩尔质量:15.5×2=31g/mol,应为氮气和氧气的混合气体.利用十字交叉法:
所以V(N2)= 又因:V(H2)+V(CO)+V(CO2)=10L-0.50L=9.5L ③ 联解①②③方程组可解得:V(H2)=4.0L;V(CO)=5.0L;V(CO2)=0.50L. 所以,m(CO)=n·M= |


科目:高中化学 来源: 题型:
| 烷烃 | 甲烷 | 乙烷 | 丙烷 | 丁烷 | 戊烷 |
| 燃烧热/(kJ?mol-1) | 890.3 | 1559.8 | 2219.9 | 2877.0 | 3536.2 |
| 7 |
| 2 |
| 7 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:2015届吉林省白山市高二上学期期末考试化学试卷(解析版) 题型:填空题
A、B、C三种强电解质,它们在水中电离出的离子为Na+、Ag+、NO3-、SO42-、Cl-,在如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙烧杯中c电极质量增加了10.8克。常温下各烧杯中溶液的pH与电解时间t的关系如图所示。据此回答下列问题:
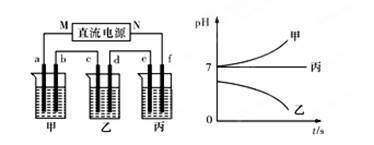
(1)M为电源的 极(填写“正”或“负”),甲、乙两个烧杯中的电解质分别为 、 (填写化学式)。
(2)计算电极f上生成的气体在标准状况下体积为 L。
(3)写出乙烧杯中的电解反应方程式: 。
(4)若电解后甲溶液的体积为10L,则该溶液的pH为 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年四川省成都市高三第一次诊断性检测(理综)化学部分 题型:填空题
据报道,在西藏冻土的一定深度下,发现了储量巨大的“可燃冰”,它主要是甲烷和水形成的水合物(CH4·nH2O)。
(1)在常温常压下,“可燃冰”会发生分解反应,其化学方程式是 。
(2)甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油。
①在101 KPa时,1.6 g CH4(g)与H2O(g)反应生成CO、H2,吸热20.64 kJ。则甲烷与H2O(g)反应的热化学方程式: 。
②CH4不完全燃烧也可制得合成气:CH4(g)+ O2(g)===CO(g)+2H2(g);
O2(g)===CO(g)+2H2(g);
△H=-35.4 kJ·mol-1。则从原料选择和能源利用角度,比较方法①和②,合成甲醇的适宜方法为(填序号);原因是 。
③在温度为T,体积为10L的密闭容器中,加入1 mol CO、2 mol H2,发生反应
CO(g)+ 2H2(g) CH3OH(g);△H=-Q kJ·mol-1(Q>O),达到平衡后的压强是开始时压强的0.6倍,放出热量Q1kJ。
CH3OH(g);△H=-Q kJ·mol-1(Q>O),达到平衡后的压强是开始时压强的0.6倍,放出热量Q1kJ。
I.H2的转化率为 ;
II.在相同条件下,若起始时向密闭容器中加入a mol CH3 OH(g),反应平衡后吸收热量Q2 kJ,且Q1+Q2=Q,则a= mol。
III.已知起始到平衡后的CO浓度与时间的变化关系如右图所示。则t1时将体积变为5L后,平衡向 反应方向移动(填“正”或“逆”);

在上图中画出从tl开始到再次达到平衡后,
CO浓度与时间的变化趋势曲线。
(3)将CH4设计成燃料电池,其利用率更高,装置示意如右图(A、B为多孔性碳棒)。

持续通人甲烷,在标准状况下,消耗甲烷体积VL。
①O<V≤44.8 L时,电池总反应方程式为 ;
②44.8 L<V≤89.6 L时,负极电极反应为 ;
③V=67.2 L时,溶液中离子浓度大小关系为 ;
查看答案和解析>>
科目:高中化学 来源:2010年湖北省高一上学期期中考试化学试卷 题型:填空题
标准状况下,向10L由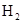 、
、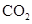 、
、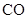 、
、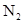 组成的混合气体中通入
组成的混合气体中通入 ,用电火花引燃,使之充分反应后,测得气体体积为7.5L,将这些气体通入盛有过量
,用电火花引燃,使之充分反应后,测得气体体积为7.5L,将这些气体通入盛有过量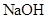 溶液的洗气瓶气体的体积变为2L,这2L气体的密度是相同状况下
溶液的洗气瓶气体的体积变为2L,这2L气体的密度是相同状况下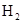 密度的15.5倍。则原混合气体中各种气体的体积(以上数据均在标准状况下测定)为:
密度的15.5倍。则原混合气体中各种气体的体积(以上数据均在标准状况下测定)为:
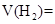 _______________;
_______________;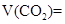 _________________;
_________________;
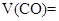 _______________;
_______________;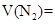 _________________。
_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com