
常温常压下,用等质量的CH4、CO2、O2、SO2四种气体分别吹出四个气球,其中气体为CH4的是
科目:高中化学 来源:2014-2015学年河北省唐山市高一上学期第一次月考化学试卷(解析版) 题型:选择题
下列叙述中,正确的是
A.硫酸的摩尔质量是98g
B.1mol氧的质量等于16g
C.摩尔是一个基本物理量
D.12g 12C所含原子数称为阿伏加德罗常数
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省赣州市高一上学期第一次月考化学卷(解析版) 题型:选择题
标准状况下,m g A气体与n g B气体分子数相等,下列说法不正确的是( )
A. 标准状况下,同体积的气体A和气体B的质量比为m∶n
B. 25 ℃时,1 kg气体A与1 kg气体B的分子数之比为n∶m
C. 同温同压下,气体A与气体B的密度之比为m∶n
D. 标准状况下,等质量的A与B的体积比为m∶n
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省景德镇高一上学期期中化学(理)试卷(解析版) 题型:填空题
(8分)用一种试剂除去下列各物质中的杂质(括号内为杂质),并写出离子方程式。
(1)BaCl2(HCl)试剂_______,离子方程式:____________________________________。
(2)CO2(HCl)试剂___________,离子方程式:__________________________________。
(3)O2(CO2)试剂__________,离子方程式:____________________________________。
(4)SO42-(CO32-)试剂_______,离子方程式:__________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省景德镇高一上学期期中化学(理)试卷(解析版) 题型:选择题
按照物质的树状分类和交叉分类,HNO3应属于
①酸 ②氢化物 ③氧化物 ④含氧酸 ⑤难挥发性酸 ⑥强氧化性酸 ⑦一元酸 ⑧化合物 ⑨混合物
A.①②③④⑤⑥⑦⑧ B.①④⑥⑦⑧
C.①⑨ D.①④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省景德镇市高二上学期期中化学(理)试卷(解析版) 题型:填空题
(共10分) 甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。反应Ⅰ:CO(g)+2H2(g)  CH3OH(g),△H1
CH3OH(g),△H1
反应Ⅱ:C02(g)+3H2(g)  CH30H(g)+ H2O(g),△H2
CH30H(g)+ H2O(g),△H2
下表所列数据是反应I在不同温度下的化学平衡常数(K):
温度 | 250℃ | 300℃ | 350℃ |
K | 2.O | 0.27 | 0.012 |
(1)在一定条件下将2 molCO和6molH2充入2L的密闭容器中发生反应I,5min后测得c(CO)=0.4 mol/L,计算此段时间的反应速率(用H2表示) mol/(L·min)。
(2)由表中数据判断△H1 0(填“>”、“<”或“=”)反应C02(g)+H2(g) CO(g)+H20(g)△H3= (用△H1和△H2表示)。
CO(g)+H20(g)△H3= (用△H1和△H2表示)。
(3)若容器容积不变,下列措施可提高反应Ⅰ中CO转化率的是 (选字母)。
a.充入CO,使体系总压强增大
b.将CH3OH(g)从体系中分离
e.充入He,使体系总压强增大
d.使用高效催化剂
(4)写出反应Ⅱ的化学平衡常数表达式:K= ;保持恒温恒容的条件下将反应Ⅱ的平衡体系各物质浓度均增加一倍,则化学平衡 (填“正向”、“逆向”或“不”)移动,平衡常数K (填“变大”、“变小”或“不变”)。
(5)这两种合成甲醇的方法比较,原子利用率较高的是 (填“Ⅰ”或“Ⅱ”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省景德镇市高二上学期期中化学(理)试卷(解析版) 题型:选择题
对于反应:N2O4(g) 2NO2(g)在温度一定时,平衡体系中NO2的体积分数φ(NO2)随压强的变化情况如图所示(实线上的对应压强下的平衡点),下列说法正确的是
2NO2(g)在温度一定时,平衡体系中NO2的体积分数φ(NO2)随压强的变化情况如图所示(实线上的对应压强下的平衡点),下列说法正确的是
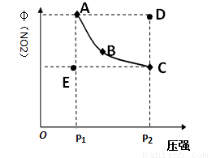
A.A、C两点的正反应速率的关系为v(A)>v(C)
B.A、B、C、D、E各状态中,v(正)<v(逆)的是状态E
C.维持P1不变,E→A所需时间为x;维持P2不变,D→C所需时间为y,则:x<y
D.使E状态从水平方向到达C状态后,再沿平衡曲线到达A状态,从理论上讲可选用的条件是从P1突然加压到P2,再由P2无限缓慢降压到P1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省高三上学期第二次月考化学试卷(解析版) 题型:实验题
(10分)氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制流程:
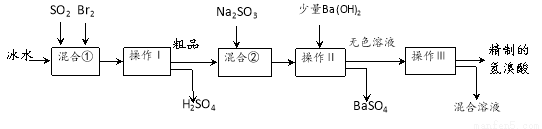
根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为 。
(2)溴与氯能以共价键结合形成BrCl,BrCl的性质与卤素单质相似。则BrCl与水发生反应的化学方程式为 。
(3)操作Ⅱ的名称是 。操作Ⅲ一般适用于分离____________混合物。(选填编号)
A.固体和液体 B.固体和固体 C.互不相溶的液体 D.互溶的液体
(4)混合②中加入Na2SO3的目的是 。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色。于是甲乙两同学设计了简单实验加以探究:
甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为 . 乙同学取制得的氢溴酸少许,向其中加入CCl4,有机物层变为橙色,则证明在该溶液中含有_________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏连云港东海县第二中学高一上第一次月考化学卷(解析版) 题型:实验题
(11分)粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥砂等不溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。通过教材中“粗盐的提纯”及你做过的该实验回答下列问题。
(1)检验SO42-已经沉淀完全的操作是: 。
(2)在粗盐经过溶解→过滤后的溶液中最后滴加饱和Na2CO3溶液,直至不再产生沉淀为止。请问这步操作的目的是 。
(3)将经过操作(2)后的溶液过滤,滤液中含NaOH和Na2CO3两种杂质,写出除去这两种杂质的化学方程式 、 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com