
 d.CH2=CHCH3.
d.CH2=CHCH3. 分析 (1)实验室制备乙炔利用碳化钙和水反应生成乙炔和氢氧化钙;
(2)电石与水反应速率太快,通常利用饱和食盐水代替水同时控制分液漏斗的活塞,使液体缓慢滴下以减慢化学反应速率;
(3)酸性KMnO4溶液能氧化乙炔,四氯化碳不吸收硫化氢,氢氧化钠与乙炔不反应,能吸收硫化氢;
(4)根据分子式确定不饱和度,利用不饱和度、性质确定结构;
(5)根据碳碳单键、碳碳双键交替出现的有机物能导电;
(6)根据乙炔在不同的催化条件下加氢可得到乙烯、乙烷,然后根据结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物来判断.
解答 解:(1)实验室制备乙炔利用碳化钙和水反应生成乙炔和氢氧化钙,反应为CaC2+2H2O→Ca(OH)2+C2H2↑,
故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;
(2)碳化钙和水之间的反应十分剧烈,为减慢反应速率,可以将水换成饱和食盐水,可以利用分液漏斗的活塞调节滴加饱和食盐水的速率,以减慢化学反应速率,
故答案为:控制分液漏斗的活塞,使液体缓慢滴下;
(3)a.酸性KMnO4溶液能氧化硫化氢,也能氧化乙炔为二氧化碳,故a错误;
b.四氯化碳不吸收硫化氢,氢氧化钠与乙炔不反应,故b错误;
c.氢氧化钠和硫化氢反应生成硫化钠和水,氢氧化钠和乙炔不反应,故c正确;
故答案为:c;
(4)CH2=CH-C≡C-CH=CH2的分子式为C6H6,不饱和度为4,不易发生加成反应,说明不含有典型的双键、三键,所以结构简式为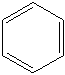 ;
;
故答案为: ;
;
(5)乙炔生成聚乙炔:nC2H2$\stackrel{催化剂}{→}$-[-CH=CH-]n-,聚乙炔中碳碳单键、碳碳双键交替出现,所以能导电;
故答案为:能;
(6)乙炔在不同的催化条件下加氢可得到乙烯、乙烷,而C2H4为乙烯,C2H6为乙烷,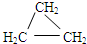 与乙烯、乙烷的结构都不相似,不属于同系物,CH2=CHCH3与乙烯结构相似,在分子组成上相差1个CH2,属于同系物,
与乙烯、乙烷的结构都不相似,不属于同系物,CH2=CHCH3与乙烯结构相似,在分子组成上相差1个CH2,属于同系物,
故选d.
点评 本题考查了乙炔的制备和性质实验,题目难度中等,注意乙炔的除杂和性质实验,注意与高锰酸钾溶液反应的物质性质,充分考查了学生对所学知识的综合运用.


科目:高中化学 来源: 题型:选择题
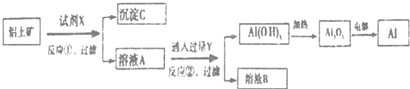
| A. | 反应①中试剂X是氢氧化钠溶液 | |
| B. | 试剂Y是HCI,它与AlO2-反应生成氢氧化铝 | |
| C. | 图中所示转化反应中包含2个氧化还原反应 | |
| D. | 将X与Y试剂进行对换,最终可以达到相同结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2(HCl):饱和碳酸钠溶液,洗气 | B. | 溴苯(溴):稀NaOH溶液,分液 | ||
| C. | 乙烷(乙烯):酸性KMnO4溶液,洗气 | D. | 乙醇(乙酸):KOH溶液,分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①③④ | B. | ②④⑤ | C. | ①③⑤ | D. | ①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 图为某学生进行粗盐提纯实验中过滤操作的示意图,试回答:
图为某学生进行粗盐提纯实验中过滤操作的示意图,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 分类标准 | 混合物 | 氧化物 | 电解质 |
| 属于该类的物质 | 1 | 2 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+>C12>MnO4- | B. | MnO4->Cl2>Fe3+ | C. | Fe3+>Cl2>I2 | D. | I2>Cl2>Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com