
(08年海南卷)(8分)反应A(g)+B(g) ![]() C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
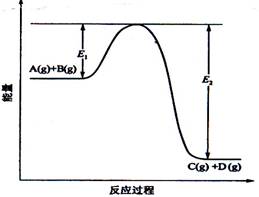
(1)该反应是____________________反应(填“吸热”“放热”);
(2)当反应达到平衡时,升高温度,A的转化率______(填“增大”“减小”“不变”),
原因是____________________________________________;
(3)反应体系中加入催化剂对反应热是否有影响?_______________,原因是_________:
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________,E2________(填“增大”“减小、”“不变”)。
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
(1)属于金属元素的有________种,金属性最强的元素与氧反应生成的化合物有___________(填两种化合物的化学式);
(2)属于稀有气体的是___________(填元素符号,下同);
(3)形成化合物种类最多的两种元素是____________________;
(4)第三周期中,原子半径最大的是(稀有气体除外)______________;
(5)推测Si、N最简单氢化物的稳定性_________大于_________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:

(1)写出A在加热条件下与H2反应的化学方程式____________。
(2)写出E与A的氢化物反应生成A的化学方程式_______________________。
(3)写出一个由D生成B的化学方程式_______________________________;
(4)将5mL0.10mol?L―1的E溶液与10mL0.10 mol?L―1的NaOH溶液混合。
①写出反应的离子方程式________________________________________;
②反应后溶液的pH ______7(填“大于”、“小于”或“等于”),理由是________;
③加热反应后的溶液,其pH________(填“增大”、“不变”或“减小”),理由是________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com