
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源:2017届湖南省邵阳市高三第二次大联考理综化学试卷(解析版) 题型:实验题
保险粉(Na2S2O4)有极强的还原性,遇热水或潮湿空气会分解发热,但在碱性环境下较稳定。回答下列问题:
(1)二氧化硫的制备
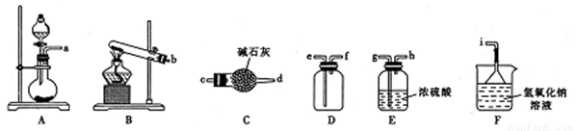
①二氧化硫的发生装置可以选择上图中的_____________(填大写字母),反应的化学方程式为______________________。
②欲收集一瓶干燥的二氧化硫,选择上图中的装置,其接口的连接顺序为发生装置→__________________→→______→______→ ____________。(按气流方向,用小写字母表示)
(2)保险粉的制备
在35-45℃下,将SO2气体通入锌粉一水悬浮液中(如图),使之发生反应生成ZnS2O4;待反应完全后,移走恒温水浴装置并冷却至室温,向三颈烧瓶中加人18%的NaOH溶液,使之发生反应生成Na2S2O4和Zn(OH)2;经一系列操作后得到无水Na2S2O4样品。
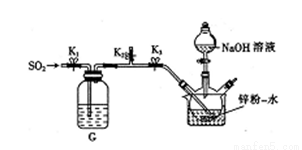
①实验开始时,应先关闭止水夹K3、打开K1和K2,通入一段时间SO2,其原因是__________。
②通过观察_________________,调节止水夹K1来控制SO2的流速。
③由ZnS2O4生成Na2S2O4的化学方程式为_____________。
(3)称取2.0gNa2S2O4样品溶于冷水中,配成100mL吐溶液,取出10mL该溶液于试管中,用0 .10 mol/L的KMnO4溶液滴定(滴定至终点时产物为Na2SO4和MnSO4),重复上述操作2次,平均消耗溶液12.00mL。则该样品中Na2S2O4的质量分数为_______(杂质不参与反应)。
查看答案和解析>>
科目:高中化学 来源:2017届湖南省、衡阳八中等十三校重点中学高三第一次联考化学试卷(解析版) 题型:选择题
将KSCN、NaHCO3、BaCl2、C6H5OH、NaOH这五种无色溶液鉴别出来的最佳试剂是
A. 浓溴水 B. 硫酸 C. FeCl3溶液 D. 硫酸铝溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二3月学业水平测试化学试卷(解析版) 题型:选择题
下列关于乙醇、乙酸的说法正确的是( )
A. 都含有羧基 B. 都能与金属钠反应生成氢气
C. 乙醇溶液显碱性,乙酸溶液显酸性 D. 都能使紫色石蕊溶液变红色
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二3月学业水平测试化学试卷(解析版) 题型:选择题
下列化学用语正确的是( )
A. 硫原子结构示意图: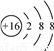
B. 乙烯分子的结构式:CH2===CH2
C. H2O2的电子式:H+[
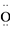

 ]H+
]H+
D. 碳酸氢钠的电离方程式NaHCO3=Na++HCO3-
查看答案和解析>>
科目:高中化学 来源:2017届四川省乐山市高三第二次调查研究考试理科综合化学试卷(解析版) 题型:简答题
碳酸亚铁(FeCO3)是菱镁矿的主要成分,将FeCO3加热到200℃开始分解为FeO和CO2,若在空气中高温煅烧FeCO3生成Fe2O3。
I.已知25℃,101kPa时:4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1648kJ/mol
C(s)+ O2(g)=CO2(g) △H=-393 kJ/mol 2FeCO3(s)=2Fe(s)+ 3O2(g) △H=+148OkJ/mol
(1)请写出FeCO3在空气中煅烧生成Fe2O3的热化学方程式_______。
Ⅱ.生成的FeO和Fe2O3在一定条件下被还原为金属铁。
(2)据报道一定条件下Fe2O3可被甲烷还原为“纳米级”的金属铁。其反应为:
Fe2O3(s)+3CH4(g)=2Fe(s)+3CO(g)+6H2(g) △H>0
① 原子序数为26的铁元素位于元素周期表的第_______周期。
②反应在5L的密闭容器中进行,2min后达到平衡,测得Fe2O3在反应中质量消耗4.8g。则该段时间内用H2表达的平均反应速率为____________。
③将一定量的Fe2O3(s)和一定量的CH4(g)置于恒温恒压容器中,在一定条件下反应,能表明该反应达到平衡状态的是___________。
a.CH4的转化率等于CO的产率 b.混合气体的平均相对分子质量不变
c.v正(CO):v逆(H2)=1:2 d.固体的总质量不变
(3)FeO可用CO进行还原,已知:t℃时,FeO(s)+CO(g) Fe(s)+CO2(g),K=0.5,若在1L密闭容器中加入0.04mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)的转化率为50%,则x=_______。
Fe(s)+CO2(g),K=0.5,若在1L密闭容器中加入0.04mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)的转化率为50%,则x=_______。
Ⅲ. Fe2O3还可用来制备FeCl3,FeCl3在水溶液中的水解分三步:
Fe3++H2O Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++ H2O Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)2++ H2O Fe (OH)3+H+ K3
Fe (OH)3+H+ K3
(4)以上水解反应的平衡常效K1、K2、K3由大到小的顺序是_______。通过控制条件,以上水解产物聚合生成聚合物的离子方程式为:xFe3++yH2O===Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法是__________(填字母)
a.加水稀释 b.加入少量NaCl固体 c.升温 d.加入少量Na2CO3固体
查看答案和解析>>
科目:高中化学 来源:2017届四川省乐山市高三第二次调查研究考试理科综合化学试卷(解析版) 题型:选择题
下列各组离子在指定条件下可能大量共存的是
A. 不能使酚酞试液变红的无色溶液中:Na+、CO32-、K+、ClO-
B. 能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、NH4+
C. 常温下水电离出的c(H+)水·c(OH-)水=10-10的溶液中:Na+、Cl-、S2-、SO32-
D. 无色透明溶液:K+、HCO3-、K+、SO42-、Fe3+
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三上学期第四次月考理科综合化学试卷(解析版) 题型:简答题
雾霾天气是一种大气污染状态,雾霾的源头多种多样,比如汽车尾气、工业排放、建筑扬尘、垃圾焚烧,甚至火山喷发等。
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化。
①已知部分化学键的键能如下
分子式/结构式 | NO/N≡O | CO/C≡O | CO2/O=C=O | N2/N≡N |
化学键 | N≡O | C≡O | C=O | N≡N |
键能(KJ/mol) | 632 | 1072 | 750 | 946 |
请完成汽车尾气净化中NO(g)和CO(g)发生反应的热化学方程式
2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=_________kJ/mol
N2(g)+2CO2(g) ΔH=_________kJ/mol
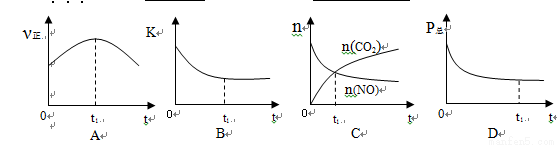
②若上述反应在恒温、恒容的密闭体系中进行,并在t1时刻达到平衡状态,则下列示意图不符合题意的是_________(填选项序号)。(下图中v正、K、n、P总分别表示正反应速率、平衡常数、物质的量和总压强)
 (2)在t1℃下,向体积为10L的恒容密闭容器中通入NO和CO , 测得了不同时间时NO和CO的物质的量如下表:
(2)在t1℃下,向体积为10L的恒容密闭容器中通入NO和CO , 测得了不同时间时NO和CO的物质的量如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/×l0-2mol | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
n(CO)/×l0-1mol | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
t1℃时该反应的平衡常数K=__,既能增大反应速率又能使平衡正向移动的措施是_。(写出一种即可)
(3)如图1所示,以N2O4为原料采用电解法可制备新型绿色硝化剂(一种氮氧化物)写出生成这种硝化剂的阳极电极反应式________________________。
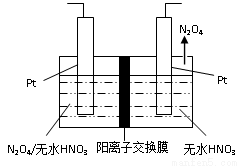
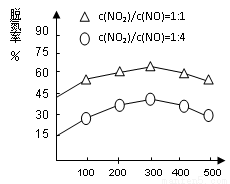
图1 图2
(4)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。在氨气足量的情况下,不同c(NO2)/c(NO)、不同温度对脱氮率的影响如图2所示(已知氨气催化还原氮氧化物的正反应为放热反应),请回答温度对脱氮率的影响____________________,给出合理的解释:____________________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一下学期第一次月考化学试卷(解析版) 题型:选择题
现有MgCl2、AlCl3、CuCl2、FeCl3、NH4Cl五种溶液,只用一种试剂就能够将它们区别开,这种试剂是( )
A. 氨水 B. AgNO3 C. NaCl D. 浓NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com