
下列解释实验事实的平衡不正确的是
| 实 验 | 解释 | |
| A | 100℃ 0.1 mol/LNa2SO4溶液pH= 6.2 | H2O |
| B | 0.1 mol/L CH3COOH的pH=3 | CH3COOH |
| C | 配制FeCl3溶液时加少量盐酸 | Fe3+ + 3OH- |
| D | 用稀硫酸洗涤BaSO4,沉淀损失小 | BaSO4(s) |
科目:高中化学 来源: 题型:
能源问题是人类社会面临的重大课题,甲
醇是一种可再生能源,具有开发和应用的广阔前景,研究
 甲醇具有重要意义。
甲醇具有重要意义。
(1)用CO合成甲醇的反应为:CO(g)+2H2(g)  CH3OH(g)
CH3OH(g)
在容积为1L。的密闭容器中分别充入1molCO和2molH2,实验 测得甲醇的物质的量和温度、时间的关系曲线如右图所示。则该正反应的△H_______0(填“<”、“>”或“=”),判断的理由是______。
(2)利用工业废气中的CO2可制取甲醇,其反应为:CO2+3H2 CH3OH+H2O。
CH3OH+H2O。
①常温常压下已知下列反应的能量变化如下图所示:

由二氧化碳和氢气制备甲醇的热化学方程式为_______。
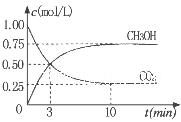 ②为探究用CO2生产燃料甲醇的反应原理,现进行如下实验:在一恒温恒容密闭容器中,充入1molCO2 和3molH2,进行上述反应。测得CO2。
②为探究用CO2生产燃料甲醇的反应原理,现进行如下实验:在一恒温恒容密闭容器中,充入1molCO2 和3molH2,进行上述反应。测得CO2。
和CH3OH(g)的浓度随时间变化如右图所示。从反应开始到
平衡,v(H2)=_______ ;该温度下的平衡常数数值K=______。
能使平衡体系中n(CH3OH)/n(CO2))增大的措施有_______(任写一条)。
(3)工业上利用甲醇制备氢气的常用方法有两种。
 ①甲醇蒸汽重整法。主要反应为;CH3OH(g)
①甲醇蒸汽重整法。主要反应为;CH3OH(g)  CO(g)+2H2(g)设在容积为2.0L的密闭容器中充入0. 60 molCH3OH(g),体系压强为P1,在一定条件下达到平衡时,体系压强为P2,且P2/P1 =2.2,则该条件下CH3OH 的平衡转化率为______ 。
CO(g)+2H2(g)设在容积为2.0L的密闭容器中充入0. 60 molCH3OH(g),体系压强为P1,在一定条件下达到平衡时,体系压强为P2,且P2/P1 =2.2,则该条件下CH3OH 的平衡转化率为______ 。
②甲醇部分氧化法。在一定温度下以Ag/CeO2-ZnO为催
化剂时原料气比例对反应的选择性(选择性越大,表示生成的该
物质越多)影响关系如右图所示。则当n(O2)/n(CH3OH) =0.25
时。CH3OH与O2发生的主要反应方程式为______ 。在制备
H2:时最好控制n(O2))/n(CH3OH)=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列用途或反应中,硫酸表现出的性质为:
A.高沸点性; B.酸性; C.吸水性; D.脱水性; E.强氧化性。
试用字母填空:
(1)实验室制取氢气: 。
(2)浓硫酸可用钢瓶贮运: 。
(3)将浓硫酸加到盐酸中产生白雾: 。
(4)实验室制取HCI气体: 。
(5)浓硫酸可使湿润的蓝色石蕊试纸先变红,后变黑: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,RO3n-与R2-发生如下反应:RO3n-+2 R2—+ 6H+ == 3R + 3H2O,
下列关于元素R的叙述中正确的是( )
A.R原子的最外层上有4个电子 B.RO3n-中的R只能被还原
C.HnRO3一定是强酸 D.R的单质既具有氧化性又具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
“金属钙线”是炼制优质钢材的脱氧脱磷剂,某“金属钙线”的主要成分为金属M和金属钙Ca,并含有3.5%(质量分数)CaO。
(1)Ca的原子结构示意图为 。其最高价氧化物对应水化物的碱性比Mg(OH)2
(填“强”或“弱”)。
(2)Ca与非金属性最强的元素A形成化合物D,用电子式表示D的形成过程:
。
(3)配平用“金属钙线”脱氧脱磷的方程式:

(4)将“金属钙线”溶于稀盐酸后,滴加少量双氧水后再滴加KSCN溶液呈红色,金属M为 (填化学式), 其中滴加双氧水发生的离子方程式是 。
(5)取3.2 g“金属钙线”试样,与水充分反应生成448 mL H2(标准状况),在所得溶液中通入适量CO2,最多能得到CaCO3 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)高温电解技术能高效实现CO2(g) + H2O(g) ==CO(g) + H2(g) +O2(g) ,工作原理示意图如下:

① 电极b发生 (填“氧化”或“还原”)反应。
② CO2在电极a放电的反应式是 。
(2)工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:

已知: Cu2O + 2H+ = Cu + Cu2+ + H2O
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
①固体混合物A中的成分是 。
②反应Ⅰ完成后,铁元素的存在形式为 。(填离子符号)
请写出生成该离子的离子方程式 。
③x的数值范围是3.2≤pH<4.0,y对应的数值范围是 。
④下列关于NaClO调pH的说法正确的是 (填序号)。
a. 加入NaClO可使溶液的pH降低
b. NaClO能调节pH的主要原因是由于发生反应ClO-+ H+ HClO,
HClO,
ClO-消耗H+,从而达到调节pH的目的
c .NaClO能调节pH的主要原因是由于NaClO水解ClO-+ H2O HClO+OH-,
HClO+OH-,
OH-消耗H+ ,从而达到调节pH的目的
⑤ 实验室配制质量分数为20.0%的CuSO4溶液,配制该溶液所需的CuSO4·5H2O与H2O的质量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
取a g某物质在氧气中完全燃烧,将燃烧产物通过足量的Na2O2固体使其完全反应,回答下列问题:
(1)若该a g物质是H2或CO,其充分燃烧后的产物通过足量Na2O2后,固体质量增加 a g(填“>、<、=”)
(2)下列物质a g充分燃烧后的产物通入足量Na2O2后固体质量增加大于a g的是
A.甲酸甲酯 B.甲醛 C.葡萄糖 D.蔗糖
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于硅和硅的化合物的叙述中,错误的是
①晶体硅的结构和金刚石相似
②硅是构成矿物和岩石的主要元素,硅是地壳中含量最多的非金属元素
③晶体硅是良好的半导体材料
④二氧化硅是制造光导纤维的重要材料
⑤二氧化硅是由两个氧原子和一个硅原子构成的
⑥二氧化硅是酸性氧化物,它不溶于任何酸
⑦硅原子既不易失去电子又不易得到电子,主要形成四价的化合物。
⑧硅的化学性质不活泼,在自然界中可以以游离态存在。
A.①②⑥⑦ B.②⑤⑥⑧ C.④⑤⑥ D.②③④⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com