
【题目】Al是应用广泛的轻金属。下列关于Al的说法不正确的是( )
A. 化学性质活泼 B. 在稀HNO3中钝化
C. 能与盐酸反应 D. 能与NaOH溶液反应
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(18分)Na2S2O3是重要的化工原料,易溶于水。在中性或碱性环境中稳定。
I.制备Na2S2O35H2O
反应原理:Na2SO3(aq)+S(s)![]() Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15g Na2SO3加入圆底烧瓶中,再加入80ml蒸馏水。另取5g研细的硫粉,用3ml 乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分加持装置略去),水浴加热,微沸60分钟。

③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O35H2O,经过滤,洗涤,干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是 。
(2)仪器a的名称是 ,其作用是 。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是 ,检验是否存在该杂质的方法是 。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子方程式表示其原因:
。
II.测定产品纯度
准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 molL1碘的标准溶液滴定。
反应原理为:2S2O32+I2=S4O62-+2I
(5)滴定至终点时,溶液颜色的变化: 。
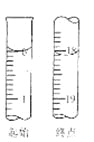
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为 mL。产品的纯度为(设Na2S2O35H2O相对分子质量为M) 。
III.Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42,常用作脱氧剂,该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2 L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是

A.200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B.200℃时,该反应的平衡常数为25
C.当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D.由图乙可知,反应xA(g)+yB(g)![]() zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池是新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂离子电池,某种锂离子电池的总反应为Li+MnO2=LiMnO2,下列说法中正确的是
A. Li是正极,电极反应式为Lie=Li+
B. Li是负极,电极反应式为Lie=Li+
C. MnO2是负极,电极反应式为MnO2+e=MnO2
D. Li是负极,电极反应式为Li2e=Li2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.用于提纯或分离物质的常见方法有:A、萃取 B、加热分解 C、结晶 D、分液 E、蒸馏 F、过滤等,请将提纯或分离的方法填在相应的横线上(填写序号)。
(1)硝酸钾溶液中混有少量氯化钠 __________________;
(2)氧化钙中混有少量的碳酸钙 ____________________;
(3)分离碳酸钙和水 ______________________________;
(4)分离植物油和水 ______________________________;
(5)分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合液(两者互溶)_________。
Ⅱ.如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)从氯化钾溶液中得到氯化钾固体,选择装置________(填代表装置图的字母,下同);除去自来水中的Cl等杂质,选择装置________。
(2)从碘水中分离出I2,选择装置________,该分离方法的名称为________。
(3)装置A中①的名称是________,进水的方向是从_____口(填“上”或“下”)进水。装置B在分液时为使液体顺利滴下,除打开漏斗下端的旋塞外,还应进行的具体操作是________________。
(4)粗盐中含Ca2+、Mg2+、Fe3+、![]() 等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液 ②加入过量的BaCl2溶液 ③过滤 ④加入过量的NaOH溶液 ⑤溶解 ⑥加盐酸调节溶液的pH等于7 ⑦蒸发
等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液 ②加入过量的BaCl2溶液 ③过滤 ④加入过量的NaOH溶液 ⑤溶解 ⑥加盐酸调节溶液的pH等于7 ⑦蒸发
操作顺序合理的是_________(填字母)。
a.⑤②④①③⑥⑦ b.⑤①②④③⑥⑦
c.⑤②①④⑥③⑦ d.⑤④②①③⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A是五元环状化合物,相对分子质量为98,其中氧元素的质量分数为49%,其核磁共振氢谱只有一个峰;反应⑤是加成反应;G是一种合成橡胶和树脂的重要原料。有关物质的转化关系如图所示:

已知:(其中R是烃基)
①
![]() 2RCOOH ②RCOOH
2RCOOH ②RCOOH![]() RCH2OH
RCH2OH
请回答以下问题:
(1)G的名称为____________________。
(2)B中官能团的名称是______________,④的反应类型是_______________。
(3)E可在一定条件下生成高分子化合物,写出该高分子化合物可能的结构简式:_______________。
(4)F属于酯类,反应⑥的化学方程式为_____________________________。
(5)有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,写出所有符合条件的Y的结构简式___________________。
(6)写出由G合成2-氯-1,3-丁二烯的合成路线(无机试剂任选):__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国是世界上最早利用煤的国家。关于煤的描述正确的是( )
A. 主要成分是硫 B. 是可再生资源
C. 燃烧只产生SO2 D. 煤干馏可制得焦炭
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2016·海南]油酸甘油酯(相对分子质量884)在体内代谢时可发生如下反应:C57H104O6(s)+80O2(g)![]()
57CO2(g)+52H2O(l)已知燃烧1 kg该化合物释放出热量3.8×104 kJ。油酸甘油酯的燃烧热△H为
A.3.8×104 kJ·mol1 B.3.8×104 kJ·mol1 C.3.4×104 kJ·mol1 D.3.4×104 kJ·mol1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com