
(15分)A、B、C、D、E为原子序数依次增大的元素,其中只有E不属于短周期,相关信息如下表:
| 元素 | A | B | C | D | E |
| 相关 信息 | 最高正价与最低负价代数和为2 | 与元素C可形成离子个数比为2:1和1:1的化合物 | 单质质软,通常保存在煤油中 | D元素可形成两种氧化物,其中一种是形成酸雨的主要成分 | 其单质是用途最广泛的金属,人体缺少该元素易患贫血症 |

(1)第三正确第IA族 (2)>
(3)取少量的样品于试管中,滴加KSCN溶液,若溶液变红色,则含有铁离子
(4)品红溶液(或氯化钡溶液) SO2(g)+2CO(g)=S(s)+2CO2(g) △H=-297.2kJ/mol
(5)c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) (6)O2+2N2O5+4e-=4NO3-
解析试题分析:A最高正价与最低负价代数和为2,则A是第ⅤA族元素,且A的原子序数最小,所以A是氮元素。C单质质软,通常保存在煤油中,则C是钠元素。B与元素C可形成离子个数比为1:2和1:1的化合物,则在短周期中符合条件的是氧化钠和过氧化钠,则B是氧元素。D元素可形成两种氧化物,其中一种是形成酸雨的主要成分,因此D是硫元素。E单质是用途最广泛的金属,人体缺少该元素易患贫血症,且E不是短周期元素,所以E是铁。
(1)钠的原子序数是11,在元素周期表中的位置是第三正确第IA族。
(2)非金属性越强,氢化物的稳定性越强,氧元素的非金属性强于硫元素,则B、D元素对应的相对分子质量最小的氢化物受热分解所需温度B>D。
(3)检验铁离子的方法是取少量的样品于试管中,滴加KSCN溶液,若溶液变红色,则含有铁离子。
(4)二氧化硫能使品红溶液褪色,因此鉴别D的两种氧化物的试剂是品红溶液;常温常压下DO2与一氧化碳反应生成 1.6g D单质与另一种氧化物,并放出14.86kJ的热量,则生成32g硫放出的热量是14.86kJ×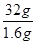 =297.2kJ,因此此反应的热化学方程式为SO2(g)+2CO(g)=S(s)+2CO2(g) △H=-297.2kJ/mol。
=297.2kJ,因此此反应的热化学方程式为SO2(g)+2CO(g)=S(s)+2CO2(g) △H=-297.2kJ/mol。
(5)硫化钠溶于水,硫离子水解溶液显碱性,则0.1mol·L-1C2D溶液中各种离子浓度从大到小的顺序是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)。
(6)根据装置图可知,氧气通入的电极应该是正极,得到电子,则电极I是负极,二氧化氮失去电子,其氧化产物Y应该是N2O5,所以根据电解质是熔融NaNO3可知电极Ⅱ的反应式是O2+2N2O5+4e-=4NO3-。
考点:考查元素推断、元素周期律、铁离子和二氧化硫检验、热化学方程式、水解以及电极反应式书写


科目:高中化学 来源: 题型:填空题
M是原子序数<30的一种金属,常用于航空、宇航、电器及仪表等工业部门,M原子的最外层有空轨道,且有两个能级处于电子半充满状态。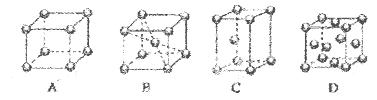
(1)M原子的外围电子排布式为_______________,在周期表中属于___________区元素。
(2)M的堆积方式属于钾型,其晶胞示意图为____(填序号)。其空间利用率为____。
(3) MCl3?6H2O有三种不同颜色的异构体
A、[M(H2O)6]Cl3,B、[M(H2O)5Cl]Cl2?H2O和C、[M(H2O)4Cl2]Cl?2H2O
为测定蒸发MCl3溶液析出的暗绿色晶体是哪种异构体,取0.10molMCl3·6H2O 配成溶液,滴加足量AgNO3溶液,得到沉淀2.870 g。该异构体为___________(填A或B或C)。
(4)常温下为暗红色液体,熔点-96. 5℃,沸点117℃,能与丙酮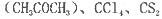 等互溶。
等互溶。
①固态MO2Cl2属于___________晶体;
②中碳原子和丙酮(CH3COCH3)羰基中的碳原子分别采取的杂化方式为______杂化和_____杂化。
(5)+3价M的配合物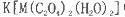 中,配体是___________,与C2O42-互为等电子体的分子是(填化学式)_______________。
中,配体是___________,与C2O42-互为等电子体的分子是(填化学式)_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
[物质结构与性质]
含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O。
(1)Cu+基态核外电子排布式为
(2)与OH-互为等电子体的一种分子为 (填化学式)。
(3)醛基中碳原子的轨道杂化类型是 ;1mol乙醛分子中含有ó的键的数目为 。
(4)含有NaOH的Cu(OH)2悬浊液与乙醛反应的化学方程式为 。
(5)Cu2O在稀硫酸中生成Cu和CuSO4。铜晶胞结构如图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为 。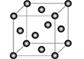
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
【化学-选修3物质结构与性质】(15分)
请回答以下问题:
(1)第四周期的某主族元素,其第一至五电离能数据如下图1所示,则该元素对应原子的M层电子排布式为 .
(2)如下图2所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是 .简述你的判断依据 .
(3)CO2在高温高压下所形成的晶体其晶胞如下图3所示.该晶体的类型属于 (选填“分子”“原子”“离子”或“金属”)晶体,该晶体中碳原子轨道的杂化类型为 。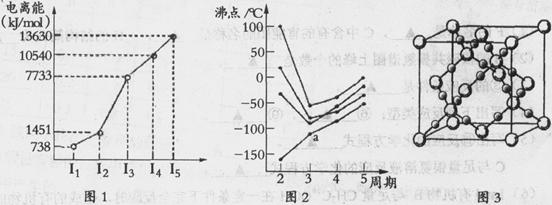
(4)在离子晶体中正、负离子间力求尽可能多的接触,以降低体系的能量,使晶体稳定存在。已知Na+半径是Cl-的a倍,Cs+半径是Cl-的b倍,请回顾课本上NaCl和CsCl的晶胞,其晶胞边长比为 .
(5)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A-D图中正确的是 .铁原子的配位数是 ,假设铁原子的半径是r cm,该晶体的密度是p g/cm3,则铁的相对原子质量为 (设阿伏加德罗常数的值为NA)。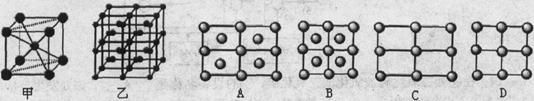 、
、
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)A、B、C、D、E、F为原子序数依次增大的短周期元素,B、C相邻且同周期,A、D同主族。C原子最外层电子数是核外电子层数的3倍,A、C能形成两种化合物甲和乙,原子个数比分别为2∶1和1∶1,甲为常见的溶剂。E是地壳中含量最多的金属元素;F元素为同周期电负性最大的元素。D和F可形成化合物丙,E和F可形成化合物丁。G为第四周期未成对电子数最多的元素。请回答下列问题:
(1)写出G基态原子的价电子排布式 。
(2) B和C比较,第一电离能较大的是 (填元素符号),其原因为 。
(3)甲、乙两分子的中心原子的杂化类型是否相同 (相同、不相同)。
(4)已知化合物丁熔点190℃,沸点183℃。丙和丁比较,熔点较高的是 (填化学式),
(5)配合物戊由G3+与甲、元素F构成,已知该配合物的配位数为6。在含有0.1mol戊的溶液中加入AgNO3溶液至过量,经过滤、洗涤、干燥后,得到28.7g白色沉淀。,则戊的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A原子、C原子的L能层中,都有两个未成对的电子,C、D同主族。 E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
⑴基态D原子中,电子占据的最高能层符号 ,该能层具有的原子轨道数为 ;
⑵E2+离子的价层电子排布图是 ,F原子的电子排布式是 ;
⑶A元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为 , B元素的气态氢化物的VSEPR模型为 ;
⑷化合物AC2、B2C和阴离子DAB-互为等电子体,它们结构相似,DAB-的电子式为 ;
⑸配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程式为 ;
⑹某种化合物由D,E,F三种元素组成,其晶胞如图所示,则其化学式为 ,该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度:
d= g/cm3。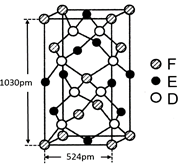
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
【化学—选修3:物质结构和性质】(15分)
元素周期表是研究元素原子结构及性质的重要工具。现有X、Y和Z三种元素,其原子序数依次减小。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子,X跟Y可形成化合物X2Y3。Z元素既可以形成正一价离子也可形成负一价离子。请回答下列问题:
(1)Y元素原子的价层电子的轨道表示式为______________,该元素的名称是_____;
(2)在X与Z形成的化合物XZ3中,X的杂化类型是 ,该化合物的空间构型为_____________;短周期元素形成的化合物中与XZ3互为等电子体的是 ;
(3)请写出X的两种含氧酸的化学式 、 ,其中酸性较强的是 。
(4)Q与Z同主族。Q单质的晶胞如下图所示,若设该晶胞的密度为ag/cm3,阿伏加德罗常数为NA,Q原子的摩尔质量为M,则表示Q原子半径的计算式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)X、Y、Z、W是常见的四种短周期元素,其原子序数依次增大。其相关信息如下表:
| 元素 | 相关信息 |
| X | X的基态原子最外层电子排布式为nsnnpn |
| Y | Y是空气中含量最高的元素 |
| Z | Z是地壳中含量最高的金属元素 |
| W | W的单质是常见的半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。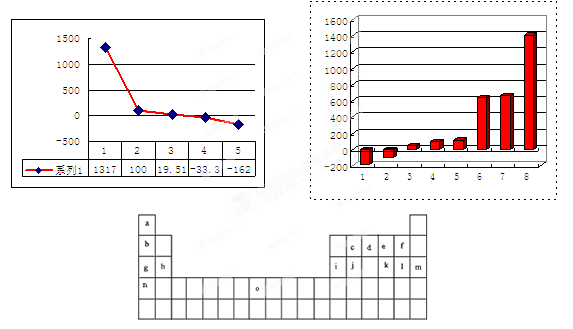
试回答下列问题
(1)元素“O”在周期表中的位置是 。
(2)画出“c”的简化电子排布式 。
(3)第三周期8种元素按单质熔点大小顺序的柱形图如上,其中序列“1”代表 (填字母)。
(4)b、c、d、e、f的氢化物的沸点(℃)直角坐标图如右,序列“5”氢化物的化学式为: ;序列“1”氢化物的电子式为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com