
分析 纯水电离生成的c(H+)=c(OH-),Kw=c(H+)×c(OH-),过量的c(OH-)=$\frac{0.9V-0.1V}{2V}$=0.4mol/L,结合Kw计算反应后溶液中c(H+),然后根据pH=-lgc(H+)计算混合液的pH.
解答 解:纯水电离生成的c(H+)=c(OH-)=2.0×10-7mol•L-1,Kw=c(H+)×c(OH-)=4.0×10-14mol•L-1,
反应后溶液中氢氧根离子浓度为:c(OH-)=$\frac{0.9V-0.1V}{2V}$=0.4mol/L,由该温度下的Kw可知,c(H+)=$\frac{4×1{0}^{-14}}{0.4}$mol/L=10-13mol•L-1,
所以反应后液的pH=-lgc(H+)=13,
故答案为:2.0×10-7;13.
点评 本题考查了溶液酸碱性与溶液pH的计算,题目难度不大,明确pH的概念及表达式为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24L苯含有的分子数为0.1NA | |
| B. | 标准状况下,11.2L乙烷中含有共价键的数目为3NA | |
| C. | 常温下,1mol羟基中含有的电子数为9NA | |
| D. | 1mol冰醋酸和lmo1乙醇在浓硫酸加热下充分反应生成H2O个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| B. | 工艺师利用盐酸刻蚀石英制作艺术品 | |
| C. | 二氧化硅可用于制备光导纤维 | |
| D. | 化学家采用玛瑙研砵磨擦固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏产物主要是各类有机物 | |
| B. | 石油的裂解、分馏和煤的干馏都属于化学变化 | |
| C. | 石油的裂化,说明长链烃在高温条件下可以分解为短链烃 | |
| D. | 煤焦油经过分馏可得到苯、甲苯等,说明煤中含有苯和甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
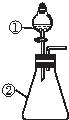 用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )| 选項 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 氢氧化钠稀溶液 | 硫酸铝铵溶液 | 立即产生白色沉淀 |
| B | 氢氧化钠浓溶液 | 用砂纸打磨过的镁条 | 立即产生大量无色气体 |
| C | 浓硫酸 | 铜粉 | 立即产生刺激性气味气体 |
| D | 盐酸 | 较浓的硝酸亚铁溶液 | 无明显现象 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液A和溶液B均可以是盐酸或NaOH溶液 | |
| B. | 实验室中方案Ⅱ更便于实施 | |
| C. | 若溶液B选用浓硝酸,测得铜的质量分数偏大 | |
| D. | 方案一可能产生氢气,方案二可能剩余铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然气是 理想的洁净能源 | |
| B. | 燃烧天然气产生的有害废气比氢气少 | |
| C. | 用天然气作燃料可解决温室效应问题 | |
| D. | 天然气、沼气的主要成分都是CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔分子的结构式:H-C≡C-H | B. | 苯的结构简式: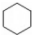 | ||
| C. | 乙醛分子的结构简式:CH3COH | D. | 甲烷分子的比例模型: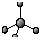 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com