
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:解答题
 某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验.
某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 采取低碳、节俭的生活方式,深入农村和社区宣传环保知识 | |
| B. | 用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同 | |
| C. | 热纯碱可以去油污,明矾可以净化水,漂白粉可用于漂白织物 | |
| D. | 海水淡化的方法有蒸馏法、电渗析法等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
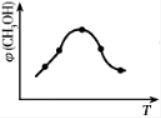
 1913年,德国化学家哈伯实现了合成氨的工业化生产,被称作解救世界粮食危机的化学天才.现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用反应:
1913年,德国化学家哈伯实现了合成氨的工业化生产,被称作解救世界粮食危机的化学天才.现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用反应: 模拟哈伯合成氨的工业化生产.当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示.
模拟哈伯合成氨的工业化生产.当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示.

 的△H=2△H1+△H2,(用含△H1、△H2的代数式表示).
的△H=2△H1+△H2,(用含△H1、△H2的代数式表示).| 容器编号 | 实验条件 | 平衡时反应中的能量变化 |
| Ⅰ | 恒温恒容 | 放热Q1kJ |
| Ⅱ | 恒温恒压 | 放热Q2kJ |
| Ⅲ | 恒容绝热 | 放热Q3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
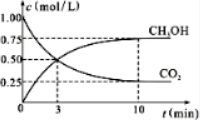
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
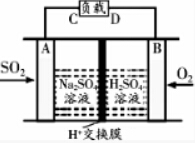
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com