
 工业上用N2和H2 合成NH3“N2(g)+3H2(g)═2NH3(g)△H<0”,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
工业上用N2和H2 合成NH3“N2(g)+3H2(g)═2NH3(g)△H<0”,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题: | 1小时 | 2 小时 | 3小时 | 4小时 |
| T3 | 30% | 50% | 80% | 80% |
| T4 | 35% | 60% | a | b |
分析 (1)根据盖斯定律来求反应的焓变,然后根据反应放出的热量与物质的量成正比;
(2)该反应为气体体积减小的放热反应,改变条件在达到新平衡的过程中正反应速率始终增大,则应为正逆反应速率都增大,且平衡向逆反应方向移动,据此答题;
(3)①根据温度升高化学平衡向着吸热方向进行;
②根据增加氢气的物质的量化学平衡向着正反应方向移动;
③根据a、b、c三点所表示的意义来回答;
③根据反应物的物质的量之比为等于化学计量数之比时,达平衡状态时生成物的百分含量最大,根据三行计算得到;
(4)根据T1和T2同时间段内N2的转化率可知T2反应温度低,N2(g)+3H2(g)═2NH3(g)△H<0,正反应为放热反应,所以T2相当于T1达到平衡时降温,平衡向正反应方向移动,达平衡时,N2的转化率较T1时高,但温度低,反应速率慢,据此判断;
(5)向绝热、恒容的密闭容器中通入H2、N2使其在一定条件下合成NH3,反应是放热反应,温度升高平衡逆向进行,平衡常数减小,据此绘制图象.
解答 解:(1)N2(g)+O2(g)═2NO(g)△H=+akJ/mol ①
N2(g)+3H2(g)═2NH3(g)△H=-bkJ/mol ②
2H2(g)+O2(g)═2H2O(g)△H=-ckJ/mol ③
由盖斯定律①×2-②×2+③×3得:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-(2a+2b-3c)kJ/mol;
则34g 即2mol氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为 $\frac{1}{2}$×[-(2a+2b-3c)kJ/mol]=(1.5c-a-b)kJ,
故答案为:(1.5c-a-b)kJ;
(2)该反应为气体体积减小的放热反应,改变条件在达到新平衡的过程中正反应速率始终增大,则应为正逆反应速率都增大,且平衡向逆反应方向移动,所以改变条件应为升温,反应速率增大,平衡逆向移动,而加压、增大c(N2)、降低c(NH3)平衡都正向移动,故选A;,
故答案为:A;
(3)①反应为放热反应,温度升高化学平衡向着吸热方向进行,从T1到T2反应物氨气的分数增加,故T1>T2,
故答案为:<;
②b点代表平衡状态,c点又加入了氢气,故平衡向右移动,氮气的转化率增大,
故答案为:c;
③当氮气和氢气的物质的量之比为1:3时达平衡状态时氨的百分含量最大,氮气起始量为0.05mol,当起始氢气的物质的量为0.15mol时氨的含量最大,依据反应的三行计算得到,
N2(g)+3H2(g)═2NH3(g)
起始量(mol) 0.05 0.15 0
变化量(mol) 0.03 0.15×0.6 0.06
平衡量(mol) 0.02 0.06 0.06
故平衡时N2的物质的量为0.05mol,所以平衡时氮气的浓度是0.02mol/l,
故答案为:0.02;
(4)根据T1和T2同时间段内N2的转化率可知T2反应温度低,N2(g)+3H2(g)═2NH3(g)△H<0,正反应为放热反应,所以T2相当于T1达到平衡时降温,平衡向正反应方向移动,达平衡时,N2的转化率较T1时高,所以a>80%,但温度低,反应速率慢,所以T2时反应可能达到平衡也可能未达平衡,所以a=b或a<b,所以80%<a=b或80%<a<b,
故答案为:80%<a=b或80%<a<b;
(5)向绝热、恒容的密闭容器中通入H2、N2使其在一定条件下合成NH3,反应是放热反应,温度升高平衡逆向进行,平衡常数减小,绘制图象为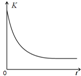 ,
,
故答案为: .
.
点评 本题主要考查了盖斯定律、化学平衡常数、外界条件对反应速率和平衡的影响,难度中等,根据课本知识即可完成.


科目:高中化学 来源: 题型:选择题
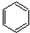 +CH3Cl$\stackrel{AlCl_{3}}{→}$
+CH3Cl$\stackrel{AlCl_{3}}{→}$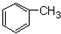 +HCl
+HCl| A. | CH3CH3和Cl2 | B. | CH2=CH2和Cl2 | C. | CH2=CH2和HCl | D. | CH3CH3和HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3•H2O的电离方程式:NH3•H2O═NH4++OH- | |
| B. | 铁发生吸氧腐蚀的正极反应:O2+2H2O+4e-═4OH- | |
| C. | 碳酸钠水解的离子方程式:CO32-+2H2O═2OH-+H2CO3 | |
| D. | 甲烷的燃烧热是890kJ/mol,则甲烷燃烧的热化学方程式:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=+890kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
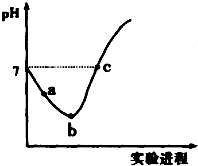 常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1的NaOH溶液,整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1的NaOH溶液,整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )| A. | 向a点所示溶液中通入SO2,溶液的酸性和漂白性均增强 | |
| B. | b点所示的溶液中:c(H+)>c(Cl-)>c(ClO-)>c(HClO) | |
| C. | 由a点到b点的过程中,溶液中$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小 | |
| D. | c 点所示溶液中:c(Na+)=2c(ClO-)+c(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
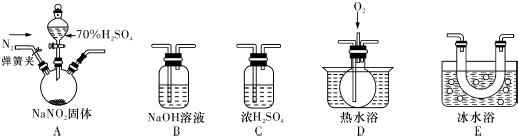
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用冰醋酸、蒸馏水和容量瓶等可以配制pH=1的醋酸溶液 | |
| B. | 在氨水中加入少量的水或氯化铵固体后,都会使溶液中的c(H+)增大 | |
| C. | 反应SiO2(s)+3C(s)═SiC(s)+2CO(g)室温下不能自发进行,则该反应的△H<0 | |
| D. | 对于Ca(OH)2的沉淀溶解平衡,升高温度,Ca(OH)2的溶解速率增大,Ksp减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钾溶液在电流作用下电离成钾离子和氯离子 | |
| B. | 二氧化硫溶于水能部分转化成离子,故二氧化硫属于弱电解质 | |
| C. | 纯净的电解质在液态时,有的导电有的不导电 | |
| D. | 硫酸钡难溶于水,所以硫酸钡属弱电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com