
【题目】下表中依据热化学方程式得到的对应结论正确的是
热化学方程式 | 结论 | |
A | 稀溶液中:H+(aq)+OH-(aq)=H2O (l) △H=-57.3kJ.mol-1 | 将稀硫酸与氢氧化钡溶液混合后,若有1molH2O 生成,则放出的能量为57.3kJ |
B | Sn(s,灰) | 锡制品在炎热的夏天更容易损坏 |
C | P4(s,白磷)=4P(s,红磷) △H=-29.2kJ.mol-1 | 常温下红磷比白磷更稳定 |
D | C3H8(g)+5O2(g)=3CO2 (g)+4H2O(g) △H=-2043.9kJ.mol-1 | C3H8的燃烧热△H=-2043.9kJ.mol-1 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】为检验浓硫酸与木炭在加热条件下反应产生SO2和CO2气体,设计了下图实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用酸性高锰酸钾溶液浸湿的脱脂棉。

请回答下列问题:
(1)实验前需进行的操作是_______________________________
(2)写出圆底烧瓶中所发生的反应方程式____________________________________________
(3)此实验成败的关键在于控制反应产生气体的速率不能过快,由此设计了虚框部分的装置,则正确的操作顺序是________(用编号填写);
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(4)实验时,装置C中的现象为______________
(5)当D中产生______(用字母填写)现象时,可以说明使E中澄清石灰水变浑的是CO2,而不是SO2;
A.进气口一端脱脂棉紫色变浅,出气口一端脱脂棉紫色不变
B.脱脂棉上紫色均变浅 C.脱脂棉上紫色褪去
则装置D的作用为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品安全关系国计民生,影响食品安全的因素很多.
(1)聚偏二氯乙烯![]()

![]() 具有超强阻隔性能,可作为保鲜食品的包装材料.它是由________
具有超强阻隔性能,可作为保鲜食品的包装材料.它是由________![]() 写结构简式
写结构简式![]() 发生加聚反应生成的,该物质的分子构型是__________________________。
发生加聚反应生成的,该物质的分子构型是__________________________。
(2)劣质植物油中的亚油酸![]() 含量很低,下列关于亚油酸的说法中,正确的是_________。
含量很低,下列关于亚油酸的说法中,正确的是_________。
A.分子式为![]()
B.一定条件下能与甘油![]() 丙三醇
丙三醇![]() 发生酯化反应
发生酯化反应
C.能和NaOH溶液反应
![]() 不能使酸性KMnO4溶液褪色
不能使酸性KMnO4溶液褪色
(3)假酒中甲醇![]() 含量超标,请写出Na和甲醇反应的化学方程式:________。
含量超标,请写出Na和甲醇反应的化学方程式:________。
(4)劣质奶粉中蛋白质含量很低.蛋白质水解的最终产物是________。
(5)在淀粉中加入吊白块制得的粉丝有毒.淀粉最终的水解产物是葡萄糖.请设计实验证明淀粉已经完全水解,写出操作、现象和结论:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有、无催化剂时,HI分解反应的能量随反应进程的变化关系如图所示,下列说法正确的是
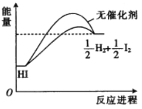
A.其他条件不变时,升高温度,平衡体系中HI的含量降低
B.图示中无催化剂的反应焓变更高
C.其他条件不变时,增大压强,可提高HI的平衡转化率
D.催化剂可提高分子的能量,加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院大连化学物理研究所在碱性锌铁液流二次电池研究方面取得了新进展,其装置如图所示。下列说法不正确的是

A.充电时,电极X与电源负极相连
B.放电时,电极Y发生氧化反应
C.充电时,阳极的电极反应式为Fe(CN)64--e-=Fe(CN)63-
D.放电时,电路中通过1 mol电子,负极锌溶解的质量为32.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;④将得到的产物熔融电解得到镁。下列说法不正确的是
A. 此法的优点之一是原料来源丰富
B. ①②③步骤的目的是从海水中获取MgCl2
C. 第④步电解得到,镁的方程式为MgCl2(熔融)![]() Mg+Cl2↑
Mg+Cl2↑
D. 提取镁的过程涉及化合、分解、置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡。根据所学知识回答下列问题:
(1)下列方法中,可以使0.10mol/LCH3COOH溶液中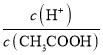 值增大的措施是_______________(填序号)。
值增大的措施是_______________(填序号)。
a.加水稀释b.加入少量CH3COONa固体 c.加入少量冰醋酸d.通入少量HCl气体 e.加少量烧碱溶液 f.升高温度
(2)t℃时,水的离子积常数Kw=1×10-12。
①该温度下,若100体积pH=a的H2SO4溶液与1体积pH=b的NaOH溶液混合后溶液呈中性,则a+b=_________。
②该温度下,pH=2的某酸HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。试分析其原因:_______________________;该混合溶液中:c(A-)-c(Na+)=______________________mol/L(填数值)。
(3)25℃下,有浓度均为0.1mol/L的三种溶液:a.NaHCO3;b.NaClO;c.CH3COONa。(已知25℃时电离常数:H2CO3 K1=4.4×10-7,K2=4.7×10-11;HClO K=3.0×10-8;CH3COOH K=1.8×10-5)
①三种溶液pH由小到大的顺序为:_______________________________(填序号)。
②溶液a的pH大于8,则溶液中c(H2CO3)_____c(CO32-)(填“>”、“<”或“=”)。
(4)已知25℃时,Ksp(AgCl)=1.8×10-10,现将足量氯化银分别放入:
a.100mL蒸馏水中;
b.100mL0.2mol/LAgNO3溶液中;
c.100mL0.1mol/L氯化铝溶液中;
d.100mL0.1mol/L盐酸溶液中。
充分搅抖后,相同温度下银离子浓度由大到小的顺序是________________(填写序号);b中氯离子的浓度为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验)

实验过程:
Ⅰ.打开弹簧夹,打开活塞 a,滴加浓盐酸
Ⅱ.当 B 和 C 中的溶液都变为黄色时,夹紧弹簧夹
Ⅲ.当 B 中溶液由黄色变为棕红色时,关闭活塞 a
Ⅳ.…
(1)A 中反应的化学方程式为:____KMnO4+_____HCl(浓)═____ KCl+____MnCl2+____Cl2↑+____H2O,则氧化性 KMnO4________Cl2(填“>”“<”或“=”).
(2)验证氯气的氧化性强于碘的实验现象是__________
(3)过程Ⅲ的实验目的是__________
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是__________。
(5)浸有 NaOH溶液的棉花团的作用是__________。此处发生 的化学方程式是__________。
(6)氰(CN)2、硫氰(SCN)2的化学性质和卤素很相似,化学上称为“类卤素”,它们阴离子的还原性强弱为:Cl- < Br- < CN- < SCN- < I-。试写出:
a.(CN)2 与 KOH 反应的化学方程式__________;
b.在 NaBr 和 KSCN 的混合溶液中加入(CN)2 的离子方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)红热木炭与浓H2SO4反应的化学方程式是C+2H2SO4![]() CO2↑+2SO2↑+2H2O,该反应中浓硫酸的作用是作___(填“氧化剂”或“还原剂”)。
CO2↑+2SO2↑+2H2O,该反应中浓硫酸的作用是作___(填“氧化剂”或“还原剂”)。
(2)SO2能够使品红溶液褪色,体现了二氧化硫具有___性。
(3)为了探究HClO的漂白性,某同学设计了如下的实验。
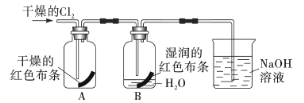
通入Cl2后,从集气瓶A中干燥的红色布条的现象可得出的结论是___,从集气瓶B中湿润的红色布条的现象可得出的结论是___,其中发生的反应是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com