
| A. | 溶液中[Fe2+]<[Fe3+] | |
| B. | 溶液中[Fe2+]>[Fe3+] | |
| C. | 部分Fe3+被氧化 | |
| D. | 在反应后的溶液中加入KSCN溶液,会出现血红色沉淀 |
分析 n(Fe)=$\frac{1.12g}{56g/mol}$=0.02mol,n(FeCl3)=c×V=2mol•L-1×0.025L=0.05mol,铁粉与氯化铁的离子反应方程式为:Fe+2Fe3+=3Fe2+,根据反应的物质的量之比等于计量数之比知,0.02mol铁粉完全反应需要0.04mol氯化铁,以此来解答.
解答 解:n(Fe)=$\frac{1.12g}{56g/mol}$=0.02mol,n(FeCl3)=c×V=2mol•L-1×0.025L=0.05mol,铁粉与氯化铁的离子反应方程式为:Fe+2Fe3+=3Fe2+,根据反应的物质的量之比等于计量数之比知,0.02mol铁粉完全反应需要0.04mol氯化铁,所以铁离子部分被还原,生成0.06mol的氯化亚铁,余0.01mol的氯化铁,所以溶液中[Fe2+]>[Fe3+],在反应后的溶液中加入KSCN溶液,会出现血红色溶液,而不是沉淀,故选B.
点评 本题考查铁的化学性质及氧化还原反应的计算,为高频考点,侧重分析与计算能力的考查,注意发生的离子反应及过量分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
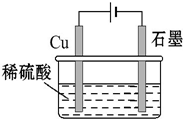
| A. | 电解过程中,铜电极上有H2产生 | |
| B. | 电解初期,主要反应方程式为:Cu+H2SO4$\frac{\underline{\;通电\;}}{\;}$CuSO4+H2↑ | |
| C. | 电解一段时间后,石墨电极上有铜析出 | |
| D. | 整个电解过程中,H+的浓度不断减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al | B. | Mg | ||
| C. | Na | D. | 三者产生的氢气一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1s | B. | 2s | C. | 4.4s | D. | 1.33s |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 第三周期元素的离子半径从左到右依次减小 | |
| B. | HCl、PCl5、N2、CO2分子中所有原子都满足最外层8电子的结构 | |
| C. | 晶体内可以不存在化学键,也可以同时存在离子键和共价键 | |
| D. | 若某离子化合物X2Y3中X3+和Y2-的电子层结构相同,则X、Y两元素的原子序数之差可能是5、15或29 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大 | B. | 减小 | ||
| C. | 不变 | D. | 可能增大也可能减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 根据右图回答下列问题:
根据右图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | B. | c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | ||
| C. | c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | D. | c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com