
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
在密闭容器中发生反应:aX(g)+bY(g) cZ(g)+dW(g)反应达到平衡后,保持温度不变,将气体压缩到原来的1/2体积,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述中不正确的是
cZ(g)+dW(g)反应达到平衡后,保持温度不变,将气体压缩到原来的1/2体积,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述中不正确的是
A.平衡向逆反应方向移动 B.a + b > c + d
C.Z的体积分数减小 D.X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。请完成下列空白:
(1)在19世纪时,铝是一种珍贵的金属。人们最初得到的铝粒如同珍宝,它的价格同黄金相当。1827年,德国化学家维勒用金属钾与无水氯化铝反应而制得了金属铝。用钾与无水氯化铝反应制铝而不用氯化铝溶液的理由是_________。 现代工业炼铝的原料是由铝土矿提取而得,在提取过程中通入的气体为____。
(2)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)  2Al2O3(s)+3TiC(s)
2Al2O3(s)+3TiC(s)
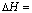 -1176 kJ·mol-1,反应过程中,每转移1 mol电子放出的热量为________。
-1176 kJ·mol-1,反应过程中,每转移1 mol电子放出的热量为________。
(3)硅与铝同周期,地壳里硅铝的含量是硅________铝(填>,<或=); Na2CaSi6O14是硅酸盐玻璃的主要成分,Na2CaSi6O14也可写成Na2O·CaO·6SiO2。盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,发生反应的化学方程式 ________。长石是铝硅盐酸,不同类长石其氧原子的物质的量分数相同。由钠长石化学式NaAlSi3O8可推知钙长石的化学式为________。
|
 3Ba↑+BaO·Al2O3, 用化学平衡移动原理解释上述方法可制取金属Ba的原因是_______________________________.
3Ba↑+BaO·Al2O3, 用化学平衡移动原理解释上述方法可制取金属Ba的原因是_______________________________. 查看答案和解析>>
科目:高中化学 来源: 题型:
有以下物质:
①6 g H2;②0.5 mol CO2;③1.204×1024个HCl分子;④147 g H2SO4;⑤4 ℃时27 mL水。
(1)它们的物质的量最大的是________。(填序号,下同)
(2)所含分子数最多的是________。
(3)所含原子数最多的是________。
(4)质量最小的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列由事实得出的结论错误的是( )
A.维勒用无机物合成了尿素,突破了无机物与有机物的界限
B.门捷列夫在前人工作的基础上发现了元素周期律,表明科学研究既要继承又要创新
C.C60是英国和美国化学家共同发现的,体现了国际科技合作的重要性
D.科恩和波普尔因理论化学方向的贡献获得诺贝尔化学奖,意味着化学已成为以理论研究为主的学科
查看答案和解析>>
科目:高中化学 来源: 题型:
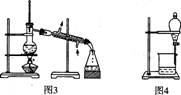
用下列实验装置进行相应实验,能达到实验目的的是
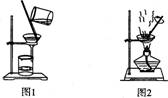
A.用图1所示装置从Fe(OH)3胶体中过滤出Fe(OH)3胶粒
B.用图2所示装置蒸发掉CuCl2溶液中部分水制得CuCl2·2H20晶体
C.用图3所示装置从CH3OH与C2H5OH的混合物中分离出乙醇
D.用图4所示装置从C2H5OH与C2H5OOCCH3的混合物中分离出乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
下列推断正确的是( )
A.由H+(aq)+OH-(aq)=H20(1) △H=-57.3 kJ·mol-1,可知含1 mo1 CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量为57.3 kJ
B.由C(石墨)=C(金刚石) △H=+1.9 kJ·mol-1,可知石墨比金刚石更稳定
C.由N2(g)+3H2(g)=2NH3(g) △H=-92.4 kJ·mol-1,可知将1 mol N2(g)和3 mol H2(g)置于密闭容器中充分反应后放出热量为92.4 kJ
D.由△G=△H-T△S可知,所有的放热反应都能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
标准状况下有①6.72 L甲烷,②3.01×1023个氯化氢分子,
③13.6 g硫化氢,④0.2 mol NH3。下列对这四种气体的关系从小到大表示不正确的是( )
A.体积:④<①<②<③ B.密度:①<④<③<②
C.质量:④<①<③<② D.氢原子数:②<④<③<①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com