
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案科目:高中化学 来源: 题型:
1. 醋酸是一种常见的弱酸,为了证明醋酸是弱电解质,某校研究性学习小组开展了题为“醋酸是弱电解质的实验研究”的探究活动。该校研究性学习小组设计了如下方案:A.先配制一定量的0.10 mol/L CH3COOH溶液,然后测溶液的pH,若pH大于1,则可证明醋酸为弱电解质
B.先测0.10 mol/L CH3COOH溶液的pH,然后将其加热至40℃,再测pH,如果pH变小,则可证明醋酸为弱电解质
C.先配制一定量0.01 mol/L和0.10 mol/L的CH3COOH溶液,分别测它们的pH,若两者的pH相差小于1个单位,则可证明醋酸为弱电解质
D.在常温下,配制一定量的CH3COONa溶液,测其pH,若pH大于7,则可证明醋酸为弱电解质。
你认为上述方案可行的是________________________________。
2. 一定温度下,有a、盐酸;b、硫酸;c、醋酸三种酸的稀溶液。(用a、b、c、<、=、>号填写)
①当其物质的量浓度相同时,c(H+)由大到小的顺序是_____ ____,②同体积同物质的量浓度的三种酸,中和同物质的量浓度的NaOH消耗的体积由大到小的顺序是_________ ③当c(H+)相同、体积相同时,分别加入足量锌,相同状况产生的气体体积由大到小的顺序___________ ④将c(H+)相同的三种酸均稀释10倍,pH由大到小的顺序为_____________
3.某温度(t ℃)时, KW=10-13,将此温度下pH=1的硫酸溶液aL与pH=12的氢氧化钡溶液bL混合。
①若所得混合液为中性,则a:b= 。
②若所得混合液的pH=2,则a:b= 。
查看答案和解析>>
科目:高中化学 来源:2013届四川乐山一中高二下学期第二阶段考试化学卷(解析版) 题型:填空题
1. 醋酸是一种常见的弱酸,为了证明醋酸是弱电解质,某校研究性学习小组开展了题为“醋酸是弱电解质的实验研究”的探究活动。该校研究性学习小组设计了如下方案:A.先配制一定量的0.10 mol/L CH3COOH溶液,然后测溶液的pH,若pH大于1,则可证明醋酸为弱电解质
B.先测0.10 mol/L CH3COOH溶液的pH,然后将其加热至40℃,再测pH,如果pH变小,则可证明醋酸为弱电解质
C.先配制一定量0.01 mol/L和0.10 mol/L的CH3COOH溶液,分别测它们的pH,若两者的pH相差小于1个单位,则可证明醋酸为弱电解质
D.在常温下,配制一定量的CH3COONa溶液,测其pH,若pH大于7,则可证明醋酸为弱电解质。
你认为上述方案可行的是________________________________。
2. 一定温度下,有a、盐酸;b、硫酸;c、醋酸三种酸的稀溶液。(用a、b、c、<、=、>号填写)
①当其物质的量浓度相同时,c(H+)由大到小的顺序是_____ ____,②同体积同物质的量浓度的三种酸,中和同物质的量浓度的NaOH消耗的体积由大到小的顺序是_________ ③当c(H+)相同、体积相同时,分别加入足量锌,相同状况产生的气体体积由大到小的顺序___________ ④将c(H+)相同的三种酸均稀释10倍,pH由大到小的顺序为_____________
3.某温度(t ℃)时, KW=10-13,将此温度下pH=1的硫酸溶液aL与pH=12的氢氧化钡溶液bL混合。
①若所得混合液为中性,则a:b= 。
②若所得混合液的pH=2,则a:b= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
草酸(H2C204)是一种重要的化工原料。已知常温下0.01 mol·L-l的H2C204、KHC204、K2C204溶液的pH如下表所示。 。.
|
| H2C204 | KHC204 | K2C204 |
| pH | 2.0 | 3.1 | 8.1 、 |
(1)在其它条件不变时,下列措施能使KHC204溶液中c(K+):c(HC204-)接近1:1的是_________(填字母)。
A.加入适量的H2C204 B.加入适量的KHC204
C.加入适量的Na2C204 D.升高溶液的温度
(2)取一定质量H2C204·2H20和KHC204的混合物,加水溶解,配成250 mL溶液,取两份此溶液各25 mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25 mol·L-l NaOH溶液至20.00 mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3 mol·L-l H2S04溶液酸化后,用0.10 mol·L-l KMnO4溶液滴定,当消耗KMnO4溶液16.00 mL时,溶液由无色变为浅紫红色。请回答下列问题:
①完成离子方程式:5C2042-+2Mn04-+16H+=10______+2Mn2++8H2O。
②原混合物中H2C204·2H20和KHC204的物质的量之比为__________。
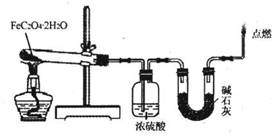
(3)某实验小组用如图所示的装置探究FeC204·2H20在隔绝空气条件下受热分解的产物。当36.0g FeC204·2H20充分反应后,残留固体质量为13.6g,浓硫酸增重7.2g,碱石灰增重11.0g。求残留固体的成分和物质的量。(已知FeC204·2H20的相对分子质量为180;设反应产生的气体被充分吸收)

查看答案和解析>>
科目:高中化学 来源:苏北四市2010届高三第二次调研考试 题型:填空题
草酸(H2C204)是一种重要的化工原料。已知常温下0.01 mol·L-l的H2C204、KHC204、K2C204溶液的pH如下表所示。 。.
|
|
H2C204 |
KHC204 |
K2C204 |
|
pH |
2.0 |
3.1 |
8.1 、 |
(1)在其它条件不变时,下列措施能使KHC204溶液中c(K+):c(HC204-)接近1:1的是_________(填字母)。
A.加入适量的H2C204 B.加入适量的KHC204
C.加入适量的Na2C204 D.升高溶液的温度
(2)取一定质量H2C204·2H20和KHC204的混合物,加水溶解,配成250 mL溶液,取两份此溶液各25 mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25 mol·L-l NaOH溶液至20.00 mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3 mol·L-l H2S04溶液酸化后,用0.10 mol·L-l KMnO4溶液滴定,当消耗KMnO4溶液16.00 mL时,溶液由无色变为浅紫红色。请回答下列问题:
①完成离子方程式:5C2042-+2Mn04-+16H+ =10______+2Mn2++8H2O。
②原混合物中H2C204·2H20和KHC204的物质的量之比为__________。
(3)某实验小组用如图所示的装置探究FeC204·2H20在隔绝空气条件下受热分解的产物。当36.0g FeC204·2H20充分反应后,残留固体质量为13.6g,浓硫酸增重7.2g,碱石灰增重11.0g。求残留固体的成分和物质的量。(已知FeC204·2H20的相对分子质量为180;设反应产生的气体被充分吸收)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com