
| A. | 28 | B. | 30 | C. | 32 | D. | 34 |
分析 氨气与稀硫酸溶液发生如下反应:2NH3+H2SO4=(NH4)2SO4(若氨气过量,则过量的氨气会溶于水);NO2和O2在溶液中发生如下反应:3NO2+H2O=2HNO3+NO、2NO+O2=2NO2,将两个反应方程式相加可得总反应方程式:O2+4NO2+2H2O=4HNO3,带火星的木头复燃说明氧气过量,则剩余的4.48L气体为O2,由质量守恒定律可得:溶液增加的质量为溶解的气体的质量,所以溶液增加的质量加剩余气体的质量为原混合气体的质量,进而计算混合气体平均相对分子质量.
解答 解:该混合气体的物质的量n=$\frac{22.4L}{22.4L/mol}$=1mol,
氨气与稀硫酸溶液发生如下反应:2NH3+H2SO4=(NH4)2SO4(若氨气过量,则过量的氨气会溶于水);NO2和O2在溶液中发生如下反应:3NO2+H2O=2HNO3+NO、2NO+O2=2NO2,将两个反应方程式相加可得总反应方程式:O2+4NO2+2H2O=4HNO3,
带火星的木头复燃说明氧气过量,则剩余的4.48L气体为O2,剩余O2的物质的量为:n=$\frac{4.48L}{22.4L/mol}$=0.2mol,则剩余的O2的质量为m=n×M=0.2mol×32g/mol=6.4g,
由质量守恒定律可得,溶液增加的质量加剩余气体的质量为原混合气体的质量,所以原混合气体的质量为:23.6g+6.4g=30g,
所以原混合气体的平均摩尔质量为:$\frac{30g}{1mol}$=30g/mol,
则混合气体的平均相对分子质量为30,
故选B.
点评 本题考查混合物有关计算,关键是利用质量守恒定律计算混合气体总质量,侧重考查学生分析计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
 磷酸铁锂动力电池(LiFePO4电池)的内部结构如图所示.中间是聚合物的隔膜,它把正极与负极隔开,锂离子可以通过而电子不能通过.该电池的总反应式为:Li1-xFePO4+LixC6═C6+LiFePO4
磷酸铁锂动力电池(LiFePO4电池)的内部结构如图所示.中间是聚合物的隔膜,它把正极与负极隔开,锂离子可以通过而电子不能通过.该电池的总反应式为:Li1-xFePO4+LixC6═C6+LiFePO4查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 A→F
A→F
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=7的溶液 | B. | c(H+)=c(OH-)=10-6mol•L-1的溶液 | ||
| C. | 能够与Na反应生成H2的溶液 | D. | 电解食盐水最后所得溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 铟元素的质量数是114.8 | |
| B. | 铟元素的相对原子质量是114 | |
| C. | 铟原子最外层有3个能量相同的电子 | |
| D. | 铟元素是一种主族元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔融的氯化钠是电解质 | |
| B. | 盐酸溶液属于非电解质 | |
| C. | 雾属于胶体,当用激光笔照射时,可以看到丁达尔现象 | |
| D. | 置换反应一定属于氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
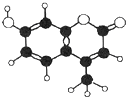 羟甲香豆素是一种激光染料,应用于可调谐染料激光器.羟甲香豆素分子模型如图所示,下列有关叙述错误的是( )
羟甲香豆素是一种激光染料,应用于可调谐染料激光器.羟甲香豆素分子模型如图所示,下列有关叙述错误的是( )| A. | 能使高锰酸钾溶液褪色 | |
| B. | 能与溴水发生取代反应和加成反应 | |
| C. | 分子式为C10H9O3 | |
| D. | 1mol羟甲香豆素最多能与3molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次外层电子数是2或8的原子一定不是副族元素 | |
| B. | 稀有气体的原子的电子排布最外层都是以P6结束 | |
| C. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 | |
| D. | 核外电子排布相同的微粒,一定具有相同的化学性质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com