
����β���ﺬ�е�NO����������ȼ��ȼ��ʱ�����ĸ�����������������Ӧ���£�N2(g)��O2(g)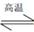 2NO(g)
2NO(g) 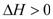
��֪�÷�Ӧ�� 2404��ʱ��ƽ�ⳣ�� K��6.4��10��3����ش��������⡣
2404��ʱ��ƽ�ⳣ�� K��6.4��10��3����ش��������⡣
(1)�÷�Ӧ��ƽ�ⳣ������ʽΪ ��
(2)���¶��£��� 2 L �ܱ������г��� N2 �� O2 �� 1 mol��ƽ��ʱ��N2 ��ת������ %(��������)��
(3)���¶��£�ijʱ�̲�������� N2��O2��NO��Ũ�ȷֱ�Ϊ2.5��10��1mol��L��1��4.0��10��2mol��L��1��3.0��10��3mol��L��1����ʱ��Ӧ________(����ڻ�ѧƽ��״̬����������������С������淽����С�)��������_______��
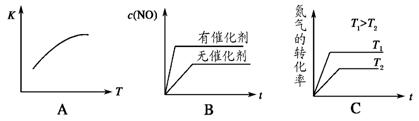
(4)�� N2��O2 �Ļ�����������º����ܱ������У���ͼ�仯������ȷ����_________��
(5)����º��ݵ��ܱ������г�������ʵ����� N2 �� O2���ﵽƽ��״̬���������г���һ���� NO�����´ﵽ��ѧƽ��״̬����ԭƽ��״̬��ȣ���ʱƽ��������NO���������_________(��������С�����䡱)��
��֪ʶ�㡿��ѧƽ��A1 G2 G3 G4
���𰸽�������1��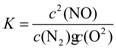 ��2��4
��2��4
��3������������� 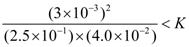
��4��AC ��5������
������N2(g)��O2(g) 2NO(g)
2NO(g)
��ʼ1mol 1mol
�仯 x x 2x
ƽ��1-x 1-x 2x��K=x2/[(1-x)/2]2=6.4��10��3��x��0.04mol��ת������4%
��Qc= (3.0��10��3)2��[(2.5��10��1)��( 4.0��10��2)]=9.0��10��4<64��10��4�����Է�Ӧ������Ӧ������С�
�����ڸ÷�Ӧ������Ӧ�����ȷ�Ӧ�����������¶ȣ���ѧƽ�������ƶ�����ѧƽ�ⳣ������A����ȷ�������������ѧ��Ӧ���ʼӿ죬�ﵽƽ������Ҫ��ʱ�����̣�����������ʹƽ�ⷢ���ƶ�����NO��ƽ��Ũ�Ȳ��䣬 B��������������¶ȣ�ƽ�������ƶ���������ת������ߣ���ѧ��Ӧ���ʼӿ죬�ﵽƽ������Ҫ��ʱ�����̣�C��ȷ��
������º��ݵ��ܱ������г�������ʵ�����N2��O2���ﵽƽ��״̬���������г���һ����NO�� ���ڸ÷�Ӧ�Ƿ�Ӧǰ�����������ȵķ�Ӧ��������ƽ����ԭƽ���Ч����ʱƽ��������NO������������䡣
���ڸ÷�Ӧ�Ƿ�Ӧǰ�����������ȵķ�Ӧ��������ƽ����ԭƽ���Ч����ʱƽ��������NO������������䡣
��˼·�㲦��ƽ���ƶ��������ƽ���ƶ�ԭ���жϣ�Ҳ�ɸ���Ũ������K�ıȽ��жϡ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����I����Cl����ϡ��Һ�е���AgNO3��Һ������������m(����)�����AgNO3��Һ���V(AgNO3)�Ĺ�ϵ��ͼ��ʾ����ԭ��Һ��c(I��)/c(Cl��)�ı�ֵΪ �� ��
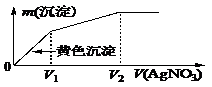
A��(V2��V1)/V1 B��V1/V2 C��V1/(V2��V1) D��V2/V1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��1L1mol/LNaOH��Һ��ȡ��100ml�����й�����100ml��Һ�������д�����ǣ�������
| �� | A�� | ��NaOH0.1mol | B�� | Ũ��Ϊ1mol/L | C�� | ��NaOH4g | D�� | Ũ��Ϊ0.1mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����98%��Ũ���ᣬ���ܶ�Ϊ1.84g/cm3�����Ƴ�Ũ��Ϊ0.5mol/L��ϡ����500ml��
��1���뽫���и�����������ȷ��������ں����ϣ�
A������Ͳ��ȡŨH2SO4
B�������ߵ�ҡ��
C���ý�ͷ�ιܼ�����ˮ���̶���
D��ϴ����������
E��ϡ��ŨH2SO4F������Һת������ƿ
�������ȷ��˳������Ϊ��D��A��E��D��C��B����
��2����Ҫ�ش��������⣺��ÿ��1�֣���9�֣�
������Ũ��������Ϊ����mL��
�����ʵ������15mL��20mL��50mL����ͲӦѡ�á���mL����Ͳ��ã���ȡʱ������Ͳ���ɾ���ˮϴ����ֱ����ȡ��ʹŨ�ȡ�������ƫ�ߡ�����ƫ�͡�������Ӱ�족����ͬ��
�۽�Ũ�������ձ��ڱ�����ע��ʢˮ���ձ��У����ò��������Ͻ��裬�������������Һ�彦���������ʹ������ҺŨ�ȡ�����
����ת������ƿǰ�ձ���Һ��Ӧ��������ȴ���������ʹŨ�ȡ�������ϴ���ձ��Ͳ�����2��3�Σ�ϴ��ҺҲҪת������ƿ�������ʹŨ�ȡ�����
�ݶ���ʱ����ʹ��Һ��Һ����̶������У������ӻ�ʹŨ�ȡ�����������ʹŨ�ȡ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ӷ���ʽ��ȷ����( )
A�����ô����ܽ⺬̼��Ƶ�ˮ����CaCO3��2H+===Ca2+��H2O��CO2��
B����ͭΪ�缫��ⱥ��ʳ��ˮ��2Cl����2H2O Cl2����H2����2OH-
Cl2����H2����2OH-
C����������Һ�еμӹ�����ˮ��Al3����4NH3��H2O=AlO2����4NH4����2H2O
D����С�մ���Һ�м����� Ba(OH)2 ��Һ��2HCO3����Ba2����2OH��=BaCO3����2H2O��CO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ȥSiO2�����л��е�CaCO3���壬������ȷ���ǣ��� ��
����A����ˮ���ˡ����� B������
����C�����������ˡ� D����NaOH��Һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
10 g�������ʵ�CaCO3�����������ᷴӦ������CO2 0.1 mol�������Ʒ�п��ܺ��е������ǣ� ����
A��KHCO3��MgCO3 B��MgCO3��SiO2 C��K2CO3��SiO2 D����ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������ѧϰ���о���ѧ��һ����Ҫ���������з����������
��A��K2CO3��K2O�������Ρ��������� B��KOH��Na2CO3�����ڼ�
��C��H2SO4��HNO3�������ᡡ���� D��Na2O��Na2SiO3������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪���������ͨʽ(OH)mXOn����ʾ����X��S��m��2��n��2�������ʽ�ӱ�ʾH2SO4��һ����ԣ���ʽ��nֵԽ������Խǿ�����и���������������ǿ����
A��HClO B��HMnO4 C��H2CO3 D��HNO2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com