
科目:高中化学 来源: 题型:选择题
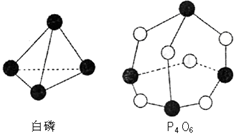 化学反应可视为旧健断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量.已知白磷和P4O6的分子结构如右图所示,现提供以下化学键的键能(kJ•mol-1)P-P:198;P-O:360;O-O:498.则反应P4(白磷)+3O2=P4O6的反应热△H为( )
化学反应可视为旧健断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量.已知白磷和P4O6的分子结构如右图所示,现提供以下化学键的键能(kJ•mol-1)P-P:198;P-O:360;O-O:498.则反应P4(白磷)+3O2=P4O6的反应热△H为( )| A. | -1638kJ/mol | B. | +1638kJ/mol | C. | -126kJ/mol | D. | +126kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
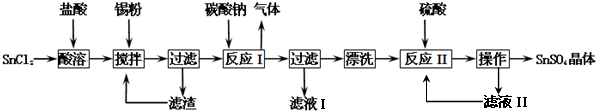
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NO(g)+O2(g)═2NO2(g) | B. | 2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g) | ||
| C. | NH4NO3(s)═NH4+(aq)+NO3-(aq) | D. | H2(g)+Cl2(g)═2HCl(l) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V (NaOH)始/mL | 0.00 | 0.20 | 0.10 | 0.10 |
| V (NaOH)终/mL | 14.98 | 15.20 | 15.12 | 16.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
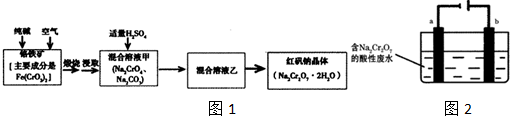
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流 程示意图如下:
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流 程示意图如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com