
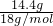 =0.8mol;
=0.8mol;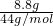 =0.2mol.
=0.2mol.

 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
 Ⅰ.氨气是氮循环中的重要物质,在人类的生产和生活中有着广泛的应用.根据所学知识,据此完成下列要求.
Ⅰ.氨气是氮循环中的重要物质,在人类的生产和生活中有着广泛的应用.根据所学知识,据此完成下列要求.| 化学式 | CO(g) | H2(g) | CH3OH(l) | CH4(g) |
| △H/(kJ/mol) | -283.0 | -285.8 | -726.5 | -890.3 |
| 3 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知在25℃、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,请回答下列问题:
已知在25℃、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,请回答下列问题:查看答案和解析>>
科目:高中化学 来源:2011-2012学年安徽省宣城市旌德中学安高一(上)期中化学试卷(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com