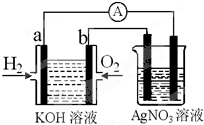
I.(1)A.燃料电池中通入燃料的电极是负极,所以a电极是负极,原电池放电时,电解质溶液中OH
-移向负极,故正确;
B.通入氧气的电极是正极,正极上得电子发生还原反应,所以b电极的电极反应为:O
2+2H
2O+4e
-=4OH
-,故正确;
C.该原电池反应不需要点燃,其电池总反应式为:2H
2+O
2=2H
2O,故错误;
D. 燃料电池放电时生成水,溶质的物质的量不变,但溶液的体积增大,所以电解质的物质的量浓度减小,则溶液的pH减小,故错误;
E.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置,(2)只需要不断补充氧化剂和还原剂即可,故正确;
故选CD;
(2)当氢氧燃料电池中消耗氢气112mL(标准状况下)时转移电子的物质的量=
×2=0.01mol,
电解硝酸银溶液的电池反应式为4AgNO
3+2H
2O=4Ag+4HNO
3+O
2↑,设硝酸的物质的量浓度为xmol/L,
4AgNO
3+2H
2O=4Ag+4HNO
3+O
2↑ 转移电子
4mol 4mol
0.1xmol 0.01mol
x=
=0.1,
所以硝酸的物质的量浓度是0.1mol/L,则溶液的pH=1,
故答案为:1;
II(1)该反应是一个反应前后气体体积减小的放热反应,
①当单位时间内生成2n mol NH
3的同时生成3n mol H
2时,说明反应v
正=v
逆,达到平衡状态,故不选;
②当单位时间内生成6n mol N-H的同时生成n mol N≡N时该反应才达到平衡状态,所以单位时间内生成n mol N-H的同时生成n mol N≡N时没有达到平衡状态,故选;
③无论反应是否达到平衡状态,同一时间段内用N
2、H
2、NH
3的物质的量浓度变化表示的反应速率之比都为1:3:2,
所以不能判断是否达到平衡状态,故选;
④但反应达到平衡状态时,各物质的物质的量不再变化则N
2、H
2、NH
3的体积分数不再改变,所以能说明达到平衡状态,故不选;
⑤根据质量守恒,反应前后混合物的质量不变,各物质的物质的量不再变化,其平均相对分子质量就不再改变,所以能说明达到平衡状态,故不选;
⑥但反应达到平衡状态时,各物质的物质的量不变,所以混合气体的总物质的量不再改变时说明达到平衡状态,故不选;
故选②③;
(2)①2小时时参加反应的氢气的物质的量=(4.50-3.60)mol=0.90mol,有3mol氢气参加反应时放出92.2kJ能量,
当0.90mol氢气参加反应时放出热量=
=27.66kJ,故答案为:27.66kJ;
②当反应进行到3小时时,生成氨气1.00mol,则参加反应的氢气的物质的量=
×3=1.50mol,n
4=4.5mol-1.5mol=3.00mol,n
3=1.50mol-
×1=1.00mol,3、4小时时各物质的物质的量不变,所以该反应在第三小时时已经达到平衡状态,平衡时c(NH
3)=
=0.5mol/L,c(H
2)=
mol/L=1.5mol/L,c(N
2)=
mol/L=0.5 mol/L,K=
=
,故答案为:
;
③反应达到平衡后,若往平衡体系中再加入N
2、H
2和NH
3各1.00mol,c(NH
3)=1mol/L,c(H
2)=2mol/L,c(N
2)=1mol/L,
浓度商=
=<K,则平衡向正反应方向移动,故答案为:正反应.



 化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料. 化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.

 2NH3 (g) ΔH=-92.2kJ·mol-1
2NH3 (g) ΔH=-92.2kJ·mol-1