
【题目】下列物质在水溶液中的电离方程式书写错误的是( )
A.HCl=H++Cl-B.H2SO4=2H++SO42-
C.CaCl2=Ca2++2Cl-D.NaOH=Na++O2- +H+
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】某草酸晶体的化学式可表示为H2C2O4xH2O,为测定x的值,进行下列实验: ①称取7.56g某草酸晶体配成100.0mL的水溶液,
②用移液管移取25.00mL所配溶液置于锥形瓶中,加入适量稀H2SO4 , 用浓度为0.600mol/L的KMnO4溶液滴定,滴定终点时消耗KMnO4 的体积为10.00mL.
(1)若滴定终点时仰视读数,则所测x的值将(填“偏大”或“偏小”).
(2)x= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期p区元素共有13种,除铝外全部是非金属元素。
(1)基态氮原子的价层电子排布图为_______________;短周期p区元素中,第一电离能最小的元素与电负性最大的元素组成的化合物是_______________(填化学式)。
(2)卤素与硼、氮、磷可形成BF3,NCl3和PBr3。下列有关以上三种分子的叙述正确的是_________;
A.化学键类型相同 B.空间构型相同
C.中心原子的杂化轨道类型相同 D.中心原子的价层电子对数相同
(3)CS2是一种溶剂,它能溶解硫磺。写出一种与CS2具有相同空间构型和键合形式的分子或离子______________。CO能与Ni形成正四面体型的配合物Ni(CO)4,3.42gNi(CO)4中含有_____molσ键。
(4)CCl4与水互不相溶,SiCl4与CCl4分子结构相似,但遇水极易发生水解反应,导致二者性质不同的原因是________________。
(5)铝的几种卤化物的熔点如下:
卤化铝 | AlF3 | AlCl3 | AlBr3 | AlI3 |
熔点/℃ | 1040 | 190 | 97.5 | 191 |
AlBr3的晶体类型是______,AlI3晶体中存在的作用力有_______________。
(6)氮化铝晶体为原子品体,是一种新型无机非金属材料,其晶体密度为ɑg/cm3,晶胞如图所示。
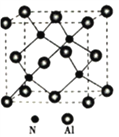
①铝原子的配位数为_______________。
②设NA为阿伏加德罗常数的值。氮化铝晶胞中,铝原子和氮原子之间最短的核间距为________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用化学平衡移动原理解释的是( )
A.光照新制的氯水时,溶液的pH逐渐减小
B.工业生产中,500℃左右比常温下更有利于合成氨
C.可用浓氨水和氢氧化钠固体快速制取氨气
D.增大压强,有利于SO2和O2反应生成SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在新制氯水中滴加NaOH 溶液,溶液中水电离出来的c水(H+)的对数与NaOH 溶液体积之间的关系如图所示。下列推断正确的是
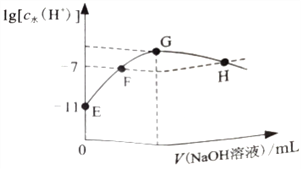
A. 用pH试纸测定E点对应的溶液,其pH=3
B. F、H点对应的溶液中都存在c(Na+)=c(Cl-)+c(ClO-)
C. 加水稀释H点对应的溶液,溶液的pH增大
D. G点对应的溶液中c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中的曲线是表示其他条件一定时,2NO(g)+O2(g) ![]() 2NO2(g) ΔH<0反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是( )
2NO2(g) ΔH<0反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是( )
A.a点
B.b点
C.c点
D.d点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列方程式
(1)浓硫酸和碳反应的化学方程式是__________________________________________;
(2)过氧化钠与二氧化碳反应的化学方程式为______________________________;
(3)高锰酸钾溶液与浓盐酸反应的离子方程式为_____________________________;
(4)氧化铝与氢氧化钠溶液反应的离子方程式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂是密度最小的活泼金属,其单质及其化合物如:LiAlH4、Li2CO3、 LiPF6等有广泛的用途。工业上以锂辉石(主要成分为LiAlSi2O6,还含有硫酸钙、硫酸镁和铁的氧化物)为原料,制备Li2CO3的的工艺流程如下:

已知①LiAlSi2O6和H2SO4会生成SiO2
②
Fe3+ | A13+ | Fe2+ | Mg2+ | |
氢氧化物完全沉淀pH | 3.2 | 4.7 | 9.0 | 11.1 |
③某些物质的溶解度(S) 如下表
t/℃ | 20 | 40 | 60 | 80 |
S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
请回答下列问题:
(1)LiAlSi2O6改写成氧化物的形式是___________________。
己知表中40℃Li2CO3溶解度(饱和溶液的密度为ag/cm3),则Li2CO3的溶度积(Ksp) 为________,(用含有a的代数式表示)
(2)步骤Ⅱ在滤液a中加入的除杂剂依次为适量的H2O2溶液,石灰乳和Na2CO3溶液,发生氧化还原反应的离子 方程式为____________________。
(3)己知滤渣2 的主要成分有Mg(OH)2 。向滤液a中加入石灰乳的作用是(运用化学平衡原理简述)___________________。用热水洗涤Li2CO3固体目的是___________________。
Ⅱ.锂单质制备及其化合物的性质
1)用碳酸锂和盐酸反应得到氯化锂溶液,写出如何从氯化锂溶液得到无水氯化锂固体的实验方法__________________。
(2) 已知2Li+H2![]() 2LiH,LiH固体密度为0 8g/cm3,用锂吸收22.4L (标准状况) H2, 生成的LiH体积与 被吸收 的 H2 体积 比 为________________。
2LiH,LiH固体密度为0 8g/cm3,用锂吸收22.4L (标准状况) H2, 生成的LiH体积与 被吸收 的 H2 体积 比 为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com