
【题目】在恒温恒容条件下,反应2X(g)+Y(g)![]() Z(g) H= -197kJ mol-1,若将2molX和1molY充入2L的密闭容器中,反应10min,测得X的物质的量为1.4mol,下列说法正确的是
Z(g) H= -197kJ mol-1,若将2molX和1molY充入2L的密闭容器中,反应10min,测得X的物质的量为1.4mol,下列说法正确的是
A. 10min内,反应放出的热量为197kJ热量
B. 10min内,X的平均反应速率为0.06mol L-1 min-1
C. 第10min时,Y的反应速率小于0.015mol L-1 min-1
D. 第10min时,Z浓度为0.6mol L-1
【答案】C
【解析】
2X(g)+Y(g)![]() Z(g)
Z(g)
起始物质的量2 1 0
改变物质的量0.6 0.3 0.3
平衡物质的量1.4 0.7 0.3
A. 10min内,反应放出的热量为197kJ/mol×0.3mol=59.1kJ热量,故错误;B. 10min内,X的平均反应速率为![]() =0.03mol L-1 min-1,故错误;C. 10min内,Y的反应速率为
=0.03mol L-1 min-1,故错误;C. 10min内,Y的反应速率为![]() =0.015 mol L-1 min-1,随着反应的进行,反应物的浓度逐渐减小,所以反应速率逐渐变小,所以当反应进行到第10min时,Y的反应速率小于0.015mol L-1 min-1,故正确;D. 第10min时,Z浓度为0.3mol/2L=0.15mol L-1,故错误。故选C。
=0.015 mol L-1 min-1,随着反应的进行,反应物的浓度逐渐减小,所以反应速率逐渐变小,所以当反应进行到第10min时,Y的反应速率小于0.015mol L-1 min-1,故正确;D. 第10min时,Z浓度为0.3mol/2L=0.15mol L-1,故错误。故选C。


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】工业上利用可逆反应N2(g)+3H2(g) ![]() 2NH3(g)合成氨,下列叙述正确的是( )
2NH3(g)合成氨,下列叙述正确的是( )
A.合成氨的适宜条件是高温高压催化剂,其中催化剂不改变该反应的逆反应速率
B.恒容通入氩气,使反应体系的压强增大,反应速率一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,NH3 (g)的浓度分别是c1、c2,则时间间隔t1~t2内,NH3 (g)生成的平均速率为v=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学设计了如图所示的实验装置来进行实验探究:
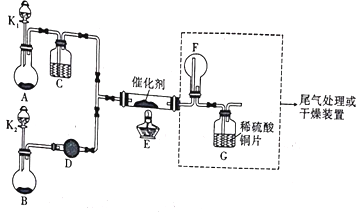
I.氨的催化氧化(4NH3+5O2 ![]() 4NO+6H2O):
4NO+6H2O):
(1)A中加入的是一种黑色的固体,B装置是制备___________的装置,D中装的试剂为___________。
(2)甲、乙同学分别按图示装置进行实验,一段时间后,装置G中的溶液都变成蓝色,甲观察到装置F中有红棕色气体,乙观察到装置F中有白烟生成。G中溶液变蓝的原因是(用离子方程式表示)______________________,白烟的成分为___________。甲、乙两同学分析了F装置现象不同的原因,乙同学通过改变实验操作:______________________,也在F中看到了红棕色气体生成。
Ⅱ.测定SO2转化为SO3的转化率:
已知:SO3的熔点是16.8℃,沸点是44.8℃。
(3)根据实验需要,应将F、G处替换成图中的装置(填序号)F.___________G._________。
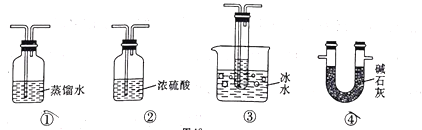
(4)在A中加入 a mol Na2SO3粉末与足量浓硫酸反应,当反应结束时,让B装置继续再反应一段时间,最后测得G处装置增重bg,则此时SO2的转化率为___________(用含a、b的代数式表示)。
(5)丙同学观察整套装置后,推断该实验结果必定偏高,他更换了一个三孔橡皮塞,改动装置后重新实验,获得了更符合实际的转化率。请推断他对装置的改动是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. CO燃烧是放热反应B. H2SO4与NaOH反应是放热反应
C. CaCO3受热分解是吸热反应D. CaO与H2O反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,Ksp(BaSO4)=1×10-10 mol2·L-2,Ksp(BaCO3)=5.1×10-9 mol2·L-2。在该温度下,下列说法不正确的是( )
A. 因为Ksp(BaCO3)>Ksp(BaSO4),所以BaSO4比BaCO3溶解度更小
B. 若误饮c(Ba2+)=1.0×10-5mol·L-1的溶液时,会引起Ba2+中毒
C. 向同浓度Na2SO4和Na2CO3的混合液中滴加BaCl2溶液,BaSO4先析出
D. 在BaSO4的饱和溶液液中,c(SO42-)=1.0×10-5mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com