
【题目】能形成离子化合物的元素组是
A. H、Cl B. Na、S C. Si、C D. Al、Mg
科目:高中化学 来源: 题型:
【题目】下列有关试剂的保存方法,错误的是( )
A. 浓硝酸保存在无色玻璃试剂瓶中
B. 氢氧化钠溶液保存在具橡皮塞的玻璃试剂瓶中
C. 少量的钠保存在煤油中
D. 新制的氯水通常保存在棕色玻璃试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是重要的消毒剂和漂白剂,可用如图所示装置制备。下列说法正确的是

A. 电极b为负极
B. 阳极区溶液的pH增大
C. 电极D的反应式为ClO2+e-=ClO2-
D. 电极E上生成标准状况下22.4 L气体时,理论上阴极区溶液质量增加135g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZnCI2是重要的工业原料,在电化学、冶金、印染等领域用途广泛,以某厂排放的废酸液(主要成分为盐酸,含Fe2+、Cu2+、Ni2+、H3AsO3等杂质)和锌蓄电池废渣(主要成分为ZnO、Zn)为原料制备ZnCl2的流程如图所示:

已知:
①25℃时,Ksp[Fe(OH)3]=4.0×10-38;Ksp[Zn(OH)2]=1.2×10-17;Ksp[Ni(OH)2]=2.0×10-15;
②溶液中的离子浓度小于等于10-5 mol·L-1时,认为该离子沉淀完全。
请问答下列问题:
(1)在元素周期表中,砷(As)元索与氮元素同主族且处于第4 周期,则砷元素的最简单氢化物的电子式为_______________;其最高价氧化物对应水化物的化学式为___________________。
(2)“浸出”过程中主要生成两种单质,其化学式为________________。
(3)控制温度为75℃左右,向滤液1中加人H2O2,生成FeAsO4的离子方程式为_________。此过程中,所加入H2O2的量需适当大于理论值,原因因为____________。
(4)蒸发滤液3制备ZnCl2时,需不断通人HC1的理由为____________。
(5)某纽扣电池放电时,总反应为Zn+Ag2O+H2O═Zn(OH)2 + 2Ag,其正极反应式为______________。
(6)25℃时,向浓度为1.0 mol·L-1的Fe3+、Zn2+、Ni2+的混合溶液中滴加NaOH溶液,当Fe3+恰好沉淀完全时,所得溶液中c(Zn2+):c(Ni2+)=_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于可逆反应的叙述正确的是( )
A. 2H2O![]() 2H2+O2 与 2H2+O2
2H2+O2 与 2H2+O2![]() 2H2O互为可逆反应
2H2O互为可逆反应
B. 可逆反应在一定条件下可达到平衡状态,该状态下,正、逆反应速率相等,都为零
C. 可逆反应不能进行到底,必然有反应物剩余
D. 可逆反应的速率很小,达到最大限度时反应停止
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列事实的解释正确的是
A. 浓硫酸具有吸水性,说明可用浓硫酸干燥氨气
B. 常温下,可用铝制容器盛装浓硫酸,说明浓硫酸与铝不反应
C. 足量铁与稀硝酸反应后溶液呈浅绿色,说明稀硝酸不能氧化Fe2+
D. 浓硝酸通常保存在棕色的试剂瓶中,说明浓硝酸不稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化镍为绿色粉末状固体,可用作搪瓷的密着剂和着色剂,陶瓷和玻璃的颜料。也可用作电子元件材料、催化剂和蓄电池材料。工业上可通过下列两种方法制取
NiCO3![]() NiO+CO2↑ Ni(NO3)2·6H2O
NiO+CO2↑ Ni(NO3)2·6H2O ![]() NiO+2HNO3+4H2O。
NiO+2HNO3+4H2O。
回答下列问题
(1)镍元素在元素周期表中的位置为__________,其价电子轨道表达式为____________________。
(2)上述两个反应涉及的非金属元素中第一电离能最大的元素为_________。其原子核外未成对电子数是__________。
(3)上述两个反应生成的非金属氧化物沸点较高的是_______,其主要原因是_________________。
(4)NO3-离子的空间构型是___________,其中心原子的杂化方式为___________。
(5)氧化镍晶体结构与氯化钠相似,其晶胞结构如下图,结构中氧离子采用面心立方最密堆积,镍离子的堆积方式是______________。

(6)纳米材料的表面原子占总原子数的比例极大,这是它有许多特殊性质的原因,假设某氧化镍纳米粒子的形状为立方体,其边长是氧化镍晶胞(如右图)的5倍,这种纳米颗粒的表面原子与总原子数的比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA,下列说法中正确的是( )
A. 标准状况下,2.24LCHC13含有的分子数为0.1NA
B. 0.1molCnH2n+2中含有的碳碳单键数为0.1nNA
C. 2.8g乙烯和丙烯的混合气体中所含碳原子为0.2NA
D. 1mol苯乙烯中含有的碳碳双键数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3是一种重要的化工原料,可以制备一系列物质(见图)。下列说法正确的是
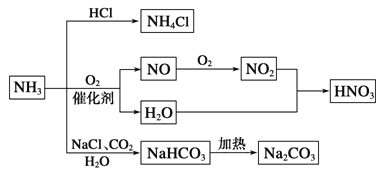
A. NH4Cl和NaHCO3都是常用的化肥
B. NH4Cl、HNO3和Na2CO3受热时都易分解
C. NH3和NO2在一定条件下可发生氧化还原反应
D. 图中所涉及的反应均为氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com