
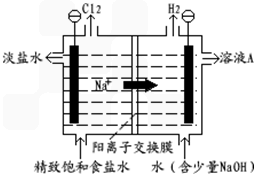
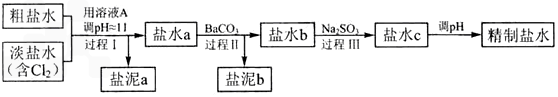
科目:高中化学 来源: 题型:
| A、硫酸生产中常采用高压条件提高SO2的转化率 | B、合成氨中采用及时分离氨气提高反应速率 | C、电解精炼铜时,溶液中c(Cu2+)基本保持不变 | D、氯碱工业电解饱和食盐水时,阳极得到氢氧化钠和氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用电解法精练粗铜时,粗铜作阳极,纯铜作阴极 | B、锌锰干电池工作时,电池的总反应为:Zn+2MnO2+2NH4+?Zn2++Mn2O3+2NH3+H2O | C、钢铁电化学腐蚀时,负极反应式为:2H2O+O2+4e-?4OH- | D、氯碱工业中电解饱和食盐水,阳极反应式为:2Cl--2e-?Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“氯碱工业”的原料是Cl2和烧碱 | B、“氯碱工业”的主要生产过程是电解饱和食盐水 | C、“氯碱工业”的主要产品是纯碱 | D、“氯碱工业”消耗的能源主要是热能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
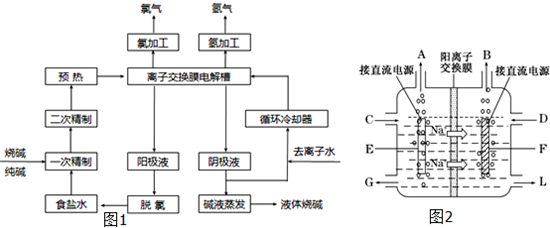
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com