
| A. | 用100 mL量筒量取12.5 mL盐酸 | |
| B. | 用托盘天平称量5.85g食盐 | |
| C. | 需用220 mL 1 mol•L-1 CuSO4溶液,配制时需称62.5g 的CuSO4•5H2O 晶体 | |
| D. | 所配得的500 mL 0.5mol•L-1 Na2CO3溶液中,Na+的物质的量浓度为0.5mol•L-1 |
分析 A.量筒的感量为0.1mL,且量筒规格应与液体的体积接近;
B.托盘天平的感量为0.1g;
C.需用220 mL 1 mol•L-1 CuSO4溶液,选择250mL容量瓶,结合m=cVM计算;
D.0.5mol•L-1 Na2CO3溶液,结合离子个数计算离子浓度.
解答 解:A.量筒的感量为0.1mL,可选20mL量筒量取12.5 mL盐酸,故A错误;
B.托盘天平的感量为0.1g,则用托盘天平称量5.8g或5.9g食盐,故B错误;
C.需用220 mL 1 mol•L-1 CuSO4溶液,选择250mL容量瓶,CuSO4•5H2O 晶体的质量为0.25L×1mol/L×250g/mol=6.25g,故C正确;
D.0.5mol•L-1 Na2CO3溶液,Na+的物质的量浓度为0.5mol•L-1×2=1mol/L,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握仪器的使用、溶液配制为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:实验题
| 化学式 | 颜色 | Ksp |
| AgCl | 白色 | 2.0×10-10 |
| AgBr | 浅黄色 | 5.4×10-13 |
| AgI | 黄色 | 8.3×10-17 |
| Ag2S | 黑色 | 2.0×10-48 |
| Ag2CrO4 | 红色 | 2.0×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
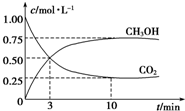 为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,T温度下,测得CO2和CH3OH(g)的浓度随时间变化如图.请回答下列问题:
为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,T温度下,测得CO2和CH3OH(g)的浓度随时间变化如图.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只具有氧化性 | B. | 只具有还原性 | ||
| C. | 既有氧化性也有还原性 | D. | 既无氧化性也无还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | p2<p1 | B. | p1<p2<2p 1 | C. | p1>2p2 | D. | 2p1=p2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3、K2CO3 | B. | AgNO3、K2CO3、HNO3 | ||
| C. | K2CO3、AgNO3 | D. | K2CO3、AgNO3、HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯能使酸性KMnO4溶液褪色,而苯和甲烷不能 | |
| B. | 苯酚能跟NaOH溶液反应而乙醇不能 | |
| C. | 乙烯能发生加成反应而乙烷不能 | |
| D. | 苯在50-60℃时发生硝化反应生成硝基苯,而甲苯在30℃时即可发生硝化反应生成三硝基甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
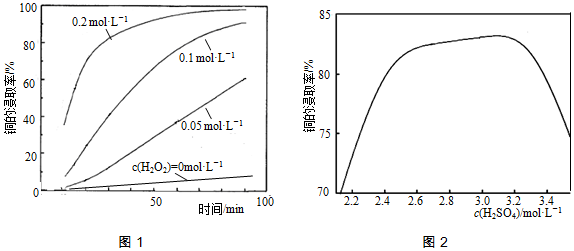
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
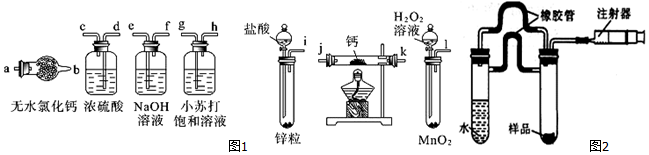
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com