
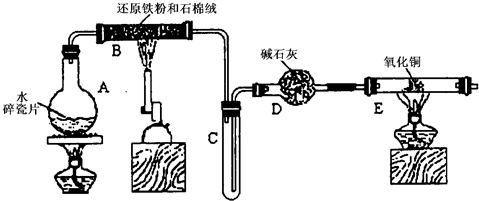
(16分)某学习小组设计了如下图所示的实验方案来探究氯气的性质。

(1)实验时甲同学在A装置中未加入任何试剂,发现B、C中的红色布条均褪色,由此甲同学得出结论:氯气具有漂白性。
实验时乙同学向A装置中加入了某种试剂,发现B中的红色布条不褪色而C中的红色布条褪色,由此乙同学得出结论:氯气没有漂白性。
你认为乙同学向A装置中加入的试剂是 ,甲、乙同学的结论正确的是 。
(2)丙同学思考后认为上面的实验装置存在缺陷,并提出了解决方法。你认为存在的缺陷是 ,解决方法为(用化学方程式表示) 。
(3)丁同学在A装置中加入滴有酚酞的NaOH溶液,观察到A装置中溶液红色逐渐褪去。他提出两种可能原因:①氯气与水反应生成次氯酸,次氯酸具有强氧化性将酚酞氧化使溶液褪色;②氯气与NaOH溶液反应使溶液褪色。请你帮助他设计一个简单的实验验证褪色的原因(简述实验步骤)。
。
(1)浓硫酸 乙 (2)无尾气的吸收装置 Cl2+2NaOH===NaCl+NaClO+H2O
(3)向褪色后的溶液中加入NaOH溶液,若观察到溶液变红色,说明褪色的原因为②;若溶液不变红色,说明褪色的原因为①
【解析】(1)由于氯气是没有漂白性的,起漂白性的是次氯酸。所以应该首先干燥氯气,因此试剂是浓硫酸。由于甲没有干燥氯气,而生成的氯气中含有水蒸气,所以甲的结论是错误的,乙的结论是正确的。
(2)由于氯气有毒,所以必须有尾气处理装置。吸收氯气可用氢氧化钠溶液,方程式为Cl2+2NaOH===NaCl+NaClO+H2O。
(3)如果是由于氯气的氧化而导致褪色,则继续加入氢氧化钠溶液,颜色将不再发生变化。但如果是由于因为中和氢氧化钠而引起的,则继续加入氢氧化钠溶液,溶液会显红色,据此可用验证,即向褪色后的溶液中加入NaOH溶液,若观察到溶液变红色,说明褪色的原因为②;若溶液不变红色,说明褪色的原因为①


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| b-d |
| 16 |
| b-d |
| 16 |
| 16(d-a) |
| b-d |
| 16(d-a) |
| b-d |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| △ |
| ||
| △ |
| ||||
|
| ||||
|
查看答案和解析>>
科目:高中化学 来源:2012-2013学年云南省玉溪一中高二上学期期末考试化学试卷(带解析) 题型:实验题
(每空2分,共16分)某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
CH3CH===CH2+CO+H2 CH3CH2CH2CHO
CH3CH2CH2CHO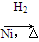 CH3CH2CH2CH2OH:
CH3CH2CH2CH2OH:
CO的制备原理:HCOOH CO↑+H2O,并设计出原料气的制备装置(如图)。
CO↑+H2O,并设计出原料气的制备装置(如图)。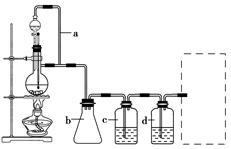
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备丙烯。写出化学方程式: ____________________________________________________________________________。
(2)若用以上装置制备H2,在虚线框内画出收集干燥H2的装置图。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是________(填序号)
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是________。
a.低温、高压、催化剂 b.适当的温度、高压、催化剂
c.常温、常压、催化剂 d.适当的温度、常压、催化剂
(5)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品,为纯化1-丁醇,该小组查阅文献得知:①R—CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓ ;②沸点:乙醚34℃,1-丁醇118℃,并设计出如下提纯路线: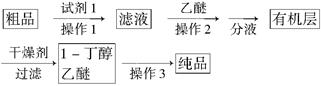
试剂1为________,操作1为________,操作2为________,操作3为________。
查看答案和解析>>
科目:高中化学 来源:2013届天津市天津一中高三第四次月考化学试卷(带解析) 题型:实验题
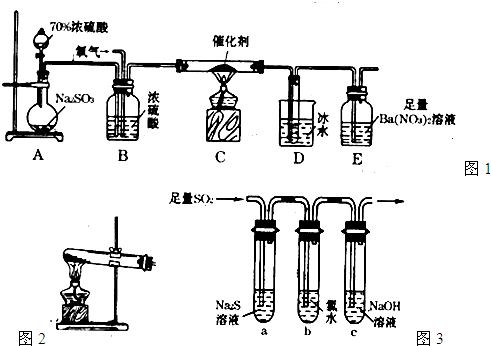
二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
(1)工业上用黄铁矿(FeS2,其中S元素为-l价)在高温下和氧气反应制备SO2: ,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为 L。
,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为 L。
(2)实验室中用下列装置测定SO2催化氧化为SO3的转化率。(已知SO3熔点为16. 8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响。) 
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作是 。
②实验过程中,需要通入氧气。试写出一个用右图所示装置制取氧气的化学方程式 。
③当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是 。
④实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是 (用含字母的代数式表示,不用化简)。
(3)某学习小组设计用如右图装置验证二氧化硫的化学性质。
①能说明二氧化硫具有氧化性的实验现象为 。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验: 
方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是 (填“I”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为 。
③当通入二氧化硫至试管c中溶液显中性时,该溶液中c(Na+)= (用含硫微粒浓度的代数式表示)。)】
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com