
����Ŀ����֪ͭ��Ũ��������ڼ��������·������·�Ӧ:Cu��2H2SO4(Ũ)![]() CuSO4��A����2H2O����ͨ�����������������������:
CuSO4��A����2H2O����ͨ�����������������������:
(1)A���ʿ���ʹ����KMnO4��Һ___________(ʵ������)����Ӧ�еĻ�ԭ����____________����ѧʽ����
(2)һ������ͭƬ��100mL18mol/L ��ŨH2SO4��ַ�Ӧ������÷�Ӧ������ת����0.2mol���ӣ����ɵ�CuSO4������Ϊ_________g, ���ɵ�A�����ڱ�״���µ����Ϊ_________L(��������ȫ���ݳ�)��
(3)����Ӧ�����õ�����Һ������Ba(OH)2��Һ��ַ�Ӧ�����ó���Ϊ�����������ᱵ������Ϊ______g��(������0.1g����Ҫ��������)
���𰸡���ɫ SO2 16 2.24 396.1
��������
��1����ԭ�Ӹ����غ㶨�ɿ�֪��Ӧ2H2SO4(Ũ)+Cu![]() CuSO4+SO2��+2H2O�У�AΪSO2������������л�ԭ�ԣ��ܹ������Եĸ����������������������ӣ�
CuSO4+SO2��+2H2O�У�AΪSO2������������л�ԭ�ԣ��ܹ������Եĸ����������������������ӣ�
��2������2H2SO4(Ũ)+Cu![]() CuSO4+SO2��+2H2O��֪ת��2mol��������1mol����ͭ��1mol�����������壻
CuSO4+SO2��+2H2O��֪ת��2mol��������1mol����ͭ��1mol�����������壻
��3����Ӧ��ʣ����ҺΪ���������ͭ��Һ��������������������������������Ӧ�������ᱵ��ˮ������ͭ������������Ӧ�������ᱵ��������ͭ������
(1)ͭ��Ũ��������ڼ��������·������·�Ӧ(��Ӧ����ʽ����ƽ)�� 2H2SO4(Ũ)+Cu![]() CuSO4+SO2��+2H2O������ԭ�Ӹ����غ��֪AΪ����������������л�ԭ�ԣ�����ʹ����KMnO4��Һ��ɫ���仹ԭ����SO2���ʴ�Ϊ����ɫ��SO2��
CuSO4+SO2��+2H2O������ԭ�Ӹ����غ��֪AΪ����������������л�ԭ�ԣ�����ʹ����KMnO4��Һ��ɫ���仹ԭ����SO2���ʴ�Ϊ����ɫ��SO2��
(2)����ת�Ƶ����غ���ܽ�n(Cu)=0.2mol/2=0.1mol������Cuԭ���غ��n(CuSO4)=n(Cu)=0.1mol������ͭ����=nM=0.1mol��160g/mol=16g������ת�Ƶ����غ�ö��������������=0.2mol/2��22.4L/mol=2.24 L���ʴ�Ϊ��16��2.24��
(3)��Ӧ��ʣ����ҺΪ���������ͭ��Һ�����ݵڣ�2���ʿ�֪��n(CuSO4)=n(Cu)=0.1mol����������������Ӧ�����ɵ�������ͭ����������ͭ��Ӧ���ĵ���������ʵ���Ϊ2n(Cu)=0.2mol����Ӧ���ʣ�����������ʵ���n(H2SO4)=18mol/L��0.1L-0.2mol=1.6mol������Һ�е��ܵ���������ӵ����ʵ���Ϊn(CuSO4)+ n(H2SO4)=1.6mol+0.1mol=1.7mol�����������������������������ᱵ�����ʵ���n(Ba SO4)=1.7mol��������Ϊ1.7mol��233g/mol=396.1g��


 ��ĩ�óɼ�ϵ�д�
��ĩ�óɼ�ϵ�д� 99��1������ĩ��ѵ��ϵ�д�
99��1������ĩ��ѵ��ϵ�д� ��ǿ��У��ĩ���100��ϵ�д�
��ǿ��У��ĩ���100��ϵ�д� �óɼ�1��1��ĩ���100��ϵ�д�
�óɼ�1��1��ĩ���100��ϵ�д� ��״Ԫ���źþ�ϵ�д�
��״Ԫ���źþ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������Ķ��ȴ�����6��ͬ���칹�壬������ȴ����ͬ���칹����
A.6��B.8��C.10��D.12��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ��������������ȷ����( )
A. һ�������£���1 mol N2��3 mol H2��ϣ���ַ�Ӧ��ת�Ƶĵ�����Ϊ6 NA
B. 1.5 mol CH4�����ĵ�����Ϊ15 NA
C. 6.4 g��S2��S4��S8��ɵĻ���ﺬ��ԭ����Ϊ0.2 NA
D. ���³�ѹ�£�11.2 L Cl2����ԭ����ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(CaO2)��һ����Ҫ����������ʵ���ҳ��øƵ����������ڼ��������·�Ӧ���Ʊ�������˵���������
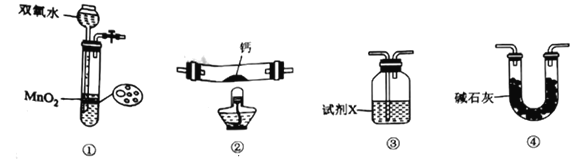
A. װ�âٿ������Ʊ�����
B. ��ȼװ�âڴ��ƾ���֮ǰ��Ӧ���ž�װ���еĿ���
C. ��װ�â����ڸ����������Լ�X����Ũ����
D. װ���ܿ���װ�â۴���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ش��������⣺
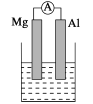
��.(1)���ձ�����ҺΪϡ���ᣬ��۲쵽��������__________��������ӦʽΪ��_______________________��
(2)���ձ�����ҺΪ����������Һ����Ϊ________(��Mg��Al)���ܷ�Ӧ��ѧ����ʽΪ________________________________��
��. (3)��Al��Cu��Ũ�������ԭ��أ��为���ĵ缫��ӦʽΪ______________________��
��.�й���ѧԺ����Ӧ�û�ѧ�о����ڼ״�ȼ�ϵ�ؼ�����������ͻ�ƣ���װ�����Ժ�����ؼ�����ʽ��ѡ��״�(CH3OH)ȼ�ϵ�صĹ���ԭ������ͼ��ʾ��
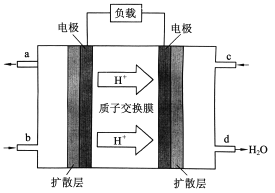
(4)�õ�ع���ʱ��b��ͨ�������Ϊ_______��c��ͨ�������Ϊ______��
(5)�õ�������ĵ缫��ӦʽΪ��_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҷ���(H2NCH2CH2NH2)����ɫҺ�壬�����ư������ʡ���֪��25��ʱ��Kb1=10-4.07Kb2=10-7.15���Ҷ�����Һ�и��������ķֲ������ģ�ƽ��ʱij��������Ũ��ռ��������Ũ��֮�͵ķ���������ҺpH�ı仯��������ͼ������˵���������

A. H2NCH2CH2NH2��ˮ��Һ�е�һ������ķ���ʽΪ��H2NCH2CH2NH2+H2O![]() H2NCH2CH2NH3++OH-
H2NCH2CH2NH3++OH-
B. ���ߢ������������Ϊ[H3NCH2CH2NH3]2+
C. ���ߢ������ߢ��ཻ���ӦpH=4.07
D. ��0.1mol��L-1 H2NCH2CH2NH3Cl��Һ�и�����Ũ�ȴ�С��ϵΪc(Cl-)>(H2NCH2CH2NH3+) >c(OH-)>c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����NaB(OH)4��Һ�Ʊ�H3BO3��ԭ������ͼ��ʾ�����������������

A. M�ҷ����ĵ缫��Ӧʽ��2H2O-4e-=O2��+4H+
B. a��cΪ�����ӽ���Ĥ��bΪ�����ӽ���Ĥ
C. N����a��<b��
D. ������ÿ����1 mol H3BO3�������ҹ�������״����16.8 L����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Ca(OH)2�������(CaWO4)�����ܵ���ʣ����ߵ��ܽ�Ⱦ����¶����߶���С������ұ�������У����������Ƽ��������Ƽ�����Һ�еõ�����ƣ�������Ӧ��WO42��(aq)�� Ca(OH)2(s) ![]() CaWO4(s)��2OH��(aq)��
CaWO4(s)��2OH��(aq)��
(1)��ͼΪ��ͬ�¶���Ca(OH)2��CaWO4�ij����ܽ�ƽ�����ߡ�

�ټ���T1ʱKsp(CaWO4)��________��
��T1________T2(�>������������<��)��
(2)��Ӧ���ƽ�ⳣ��K����ֵ�����ʾ��
�¶�/�� | 25 | 50 | 90 | 100 |
K | 79.96 | 208.06 | 222.88 | 258.05 |
�ٸ÷�Ӧƽ�ⳣ��K�ı���ʽΪ________________��
�ڸ÷�Ӧ�Ħ�H________0(�>������������<��)��
��������Һ�����Ӽ������ã�ʵ���õ�ƽ�ⳣ��������ֵ�����Զ��50��ʱ����һ������������Ƽ�����Һ[c(Na2WO4)��c(NaOH)��0.5mol��L��1]�У��������Ca(OH)2����Ӧ�ﵽƽ���WO42���ij�����Ϊ60%������ʵ���õ�ƽ�ⳣ��________________��
(3)��ȡ�����ʱ����ʱ��Ӧ���Һ�������������ᣬ�������ã� __________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС�鹹�뽫����β��(NO��NO2)ת��Ϊ��Ҫ�Ļ���ԭ��HNO3����ԭ����ͼ��ʾ������A��BΪ�������ϡ�����˵��һ����ȷ���ǣ� ��

A. �õ�ع���ʱ�����ӵ��������·��A��B���ڵ�·��B��A�γɱպϻ�·
B. �缫B������HNO3Ũ������
C. A�缫�ķ�ӦΪ��NO2��e����H2O==NO3-��2H�� NO��3e����2H2O===NO3-��4H��
D. �õ�ع���ʱ��ÿ����11.2LO2(��״����)�����Գ�ȥ��1molNO��NO2�Ļ��β��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com