
A.3 min B.1 min
C.30 s D.20 s
 小学教材全测系列答案
小学教材全测系列答案科目:高中化学 来源: 题型:
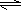 H2CO3+OH-且HCO3-水解程度大于电离程度,故溶液呈碱性
H2CO3+OH-且HCO3-水解程度大于电离程度,故溶液呈碱性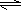 H2CO3+OH-且HCO3-水解程度大于电离程度,故溶液呈碱性
H2CO3+OH-且HCO3-水解程度大于电离程度,故溶液呈碱性查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
| pH | 9.8 | 9.7 | 11.6 | 10.3 |
| 16 |
| 3 |
| 16 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
10 ℃时,将等浓度、等体积的Na2S2O3和稀H2SO4混合,9 min 后溶液中明显出现浑浊。若温度每升高10 ℃,化学反应速率增大到原来的3倍,那么,40 ℃时,同样反应要明显看到浑浊,需要的时间是( )
A.3 min B.1 min C.30 s D.20 s
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com