
含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料—光导纤维,C与烧碱反应生成含A元素的化合物D
(1)B元素的原子最外层电子数与A相同,则B在元素周期中的位置___ __.
(2)写出易与C发生反应的酸与C反应的化学方程式是______________.
(3)将C与纯碱混合高温熔融时也发生化学反应生成D,同时还生成B的最高价氧化物E:将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物F.
①写出生成D的化学反应方程式:______________.
②要将纯碱高温熔化,下列坩埚中不可选用的是__________.
A.普通玻璃坩埚 | B.石英玻璃坩埚 | C.铁坩埚 | D.瓷坩埚. |
③将过量的E通入D的溶液中发生反应的离子方程式是:_________________。
(4)100 g C与石灰石的混合物充分反应后,生成的气体在标准状况下的体积为11.2 L,100 g混合物中石灰石的质量分数是____________。
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上第二次适应性考试化学卷(解析版) 题型:选择题
已知四种盐的溶解度(S)曲线如下图所示,下列说法不正确的是( )
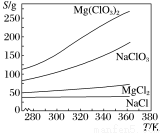
A.将NaCl溶液蒸干可得NaCl固体
B.将MgCl2溶液蒸干可得MgCl2固体
C.Mg(ClO3)2中混有少量NaCl杂质,可用重结晶法提纯
D.可用MgCl2和NaClO3制备Mg(ClO3)2
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上第二次适应性考试化学卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式是
A.向次氯酸钙溶液通入过量CO2:Ca2++2ClO—+CO2+H2O =CaCO3↓+2HClO
B.向次氯酸钙溶液通入SO2:Ca2++2ClO—+SO2+H2O= CaSO3↓+2HClO
C.氢氧 化钙溶液与碳酸氢镁溶液反应:HCO3—+Ca2++OH—=CaCO3↓+H2O
化钙溶液与碳酸氢镁溶液反应:HCO3—+Ca2++OH—=CaCO3↓+H2O
D.在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3—=3Fe 3++NO↑+2H2O
3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上第二次月考化学试卷(解析版) 题型:实验题
过碳酸钠(2Na2CO3•3H2O2)是由Na2CO3与H2O2复合而形成的一种固体放氧剂,同时具有Na2CO3和H2O2双重性质。可用于洗涤、纺织、医药、卫生等领域.工业上常以过碳酸钠产品中活性氧含量([O]%= 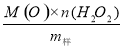 ×100来衡量其优劣,13%以
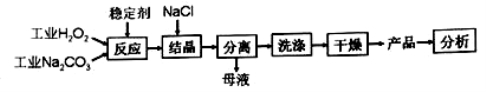
×100来衡量其优劣,13%以 上为优等品。一种制备过碳酸钠的工艺流程如图:
上为优等品。一种制备过碳酸钠的工艺流程如图:
回答下列问 题:
题:
(1)过碳酸钠受热易分解,写出反应的化学方程式_____________________.
(2)稳定剂及反应温度等因素对产品质量有很大影响.
①下列试剂中,可能用作“稳定剂”的是__________(填字母).
a.MnO2 b.KI c .Na2SiO3 d.FeCl3
.Na2SiO3 d.FeCl3
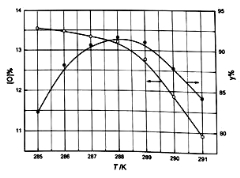
②反应温度对产品产率(y%)及活性氧含量的影响如下图所示.要使产品达到优等品且产率超过90%合适的反应温度范围是_______________.
③“结晶”时加入NaCl的目的是____________ .
(3)“母液”中可循环利用的主要物质是_________________ ___.
___.
(4)产品中活性氧含量的测定方法:称量0.1600g样品,在250mL锥形瓶中用100mL 0.5mol•L-1硫酸溶解完全,立即用0.02000mol•L-1高锰酸钾标准溶液滴定,至溶液呈浅红色且半分钟内不褪色即为终点,平行三次,消耗KMnO4溶液的平均体积为26.56mL。另外,在不加样品的情况下按照上述过程进行空白实验,消耗KMn04溶液的平均体积为2.24mL.
①过碳酸钠与硫酸反应,产物除硫酸钠和水外,还有_______________.
②测定时,若用工业盐酸代替硫酸,分析对测定结果的影响 (填“偏大”、“偏小”或“不变”)及其原因____________.
③该样品的活性氧含量为__________% 。
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上第二次月考化学试卷(解析版) 题型:选择题
三支体积相等的试管分别充满标准状态下的气体:①氨气;②体积比为4:1的NO2和O2;③NO2气体;将它们分别倒立于盛有足量水的水槽中,液面恒定后(假设试管内液体扩散),则下列结论中正确的是
A.①和③试管内溶液的体积不等,溶质的物质的量浓度也不相等
B.因为它们都可溶于水,所以液面都上升到试管顶部
C.三支试管中,试管②中溶液的溶质的物质的量浓度最小
D.试管②和试管③中溶液的溶质的物质的量浓度一定相等
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上第二次月考化学试卷(解析版) 题型:选择题
室温时,在容积为amL的试管中充满NO2气体,然后倒置在水中到管内水面不再上升时为止;再通入bmLO2,则管内液面又继续上升,测得试管内最后剩余气体为cmL,且该气体不能支持燃烧。则a、b、c的关系是
A.a=4b+3c B.a=4b+c C.a:b=4:1 D.a:b=4:3
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
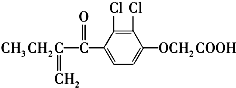 利尿酸是奥运会上被禁用的兴奋剂之一,其结构简式如下:
利尿酸是奥运会上被禁用的兴奋剂之一,其结构简式如下:| A. | 利尿酸分子内处于同一平面的原子数不超过10个 | |
| B. | 利尿酸的衍生物利尿酸甲酯的分子式是C14H14Cl2O4 | |
| C. | 该有机物有4种官能团 | |
| D. | 利尿酸能与FeCl3溶液发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁及其化合物是一类重要的物质,在人类的生产和生活中具有广泛的用途.
铁及其化合物是一类重要的物质,在人类的生产和生活中具有广泛的用途.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com