
【题目】(一)某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol/L 的溶液。在FeCl2溶液中需加入少量铁屑,用离子方程式解释其目的__________________________。
(2)甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______________。
(3)乙组同学认为甲组的实验不够严谨,请你代表乙组发表改进方案_____________。
(二)工业上用赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO、SiO2等)制备绿矾FeSO4·7H2O的流程如下:
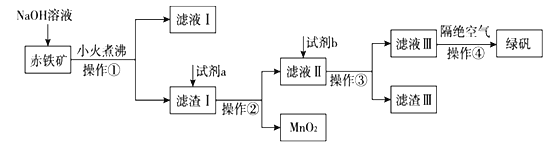
(4)氢氧化钠溶液加入赤铁矿中发生反应的离子方程式为____________________________。
(5)向滤渣Ⅰ中加入过量的试剂a为___________,加入过量试剂b后所得滤渣Ⅲ的主要成分为______。
(6)操作③需要的玻璃仪器主要包括_______________。
(7)操作④需要隔绝空气的主要原因可能是什么?______________________________________。
【答案】2Fe3++Fe=3Fe2+ 2Fe2++ Cl2=2Fe3++2Cl- 在FeCl2溶液的液面上覆盖一层煤油,就可以使溶液与空气隔离,排除氧气对实验的影响; Al2O3+2OH-=2AlO2-+ H2O、SiO2+2OH-=SiO32-+ H2O 稀硫酸 铁和铜 漏斗、玻璃棒、烧杯 防止硫酸亚铁被氧化
【解析】
(一)铁和氯化铁反应生成氯化亚铁,氯气与氯化亚铁反应产生氯化铁;利用SCN-与Fe3+反应产生血红色溶液检验Fe3+;煤油不溶于水,密度比水小,可以隔离溶液与空气接触,排除氧气对实验的影响。
(二)赤铁矿加NaOH后,Al2O3、SiO2与NaOH反应,则滤液I中含OH-、AlO2-、SiO32-,滤渣I中含Fe2O3、FeO、MnO2、CuO,加试剂a为硫酸,操作①②均为过滤,滤液Ⅱ中含硫酸、Fe2(SO4)3、FeSO4、CuSO4,试剂b为Fe,操作③为过滤,滤渣Ⅲ为Cu、Fe,滤液Ⅲ含FeSO4,蒸发浓缩、冷却结晶可得到绿矾,以此来解答。
(1)在FeCl2溶液中加入少量铁屑,铁和氯化铁反应生成氯化亚铁,就可以防止硫酸亚铁溶液变质,反应的方程式是2Fe3++Fe=3Fe2+;
(2)氯气具有氧化性,能氧化氯化亚铁为氯化铁,反应的离子方程式为:Cl2+2Fe2+=2Fe3++2Cl-,反应产生的Fe3+遇SCN-生成血红色物质,使溶液变为红色,因此可用KSCN溶液检验氯气能否氧化FeCl2;
(3)由于空气中的氧气可以溶解在FeCl2溶液中,而氧化FeCl2,所以甲同学方案不严谨,改进方案是在FeCl2溶液的液面覆盖一层煤油。由于煤油不溶于水,密度比水小,分层后可以隔离溶液与空气接触,从而排除氧气对实验的影响;
(4)NaOH溶液加入赤铁矿中,与氧化铝、二氧化硅发生反应,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O、SiO2+2OH-=SiO32-+H2O;
(5) Fe2O3、FeO、MnO2、CuO不能与NaOH反应,进入滤渣I,为制取硫酸亚铁,向滤渣I中加入试剂a为硫酸,氧化物中的Fe2O3、FeO、CuO与硫酸反应,产生Fe2(SO4)3、CuSO4、FeSO4,MnO2不能反应,以固体形式存在,过滤得滤液II,试剂b为Fe,将足量的Fe投入到滤液Ⅱ中,发生反应Fe+2Fe3+=3Fe2+、Fe+Cu2+=Cu+Fe2+、Fe+2H+=H2↑+Fe2+。置换出的Cu及过量的Fe通过过滤进入滤渣III中,所以滤渣Ⅲ主要成分铁和铜;
(6)分离难溶性固体和溶液采用过滤方法,需要的玻璃仪器主要包括漏斗、玻璃棒、烧杯;
(7) Fe2+不稳定,易被空气氧化生成Fe3+,所以操作④隔绝空气的目的是防止溶液中的Fe2+被空气氧化为Fe3+。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】用氧化铝作原料,碳热法冶铝的两步反应为:
①2173~2473K时:2Al2O3+9C![]() Al4C3+6CO↑;
Al4C3+6CO↑;
②温度高于2473K时:Al2O3+Al4C3![]() 6Al+3CO↑.
6Al+3CO↑.
下列有关说法不正确的是( )
A. A12O3属于两性氧化物
B. 两步反应中CO均是氧化产物
C. Al4C3与盐酸反应可生成烃,该烃为乙烯
D. 生成的铝粉不能在空气中冷却
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红热的铁能与水蒸气反应,有氢气生成,现用如图所示装置进行铁在高温下与水蒸气反应的实验,并用简单的方法收集、检验生成的氢气。请回答下列问题:
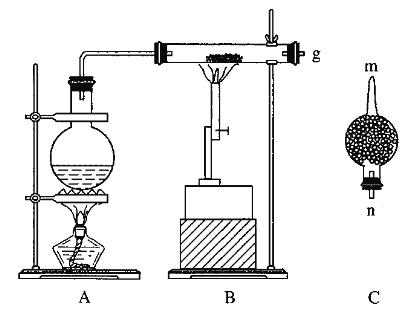
(1)写出铁在高温下与水蒸气反应的化学方程式:____________________________。
(2)干燥管C中盛放的是碱石灰,其作用是___________________。
(3)把B中反应后的产物加入足量的盐酸,用该溶液制取FeCl3·6H2O晶体。
①欲检验溶液中含有Fe3+,选用的试剂为____________,现象是______________________。
②该实验小组同学用上述试剂没有检测到Fe3+,用离子方程式解释滤液中不存在Fe3+可能的的原因:_________________。
③将此滤液中FeCl2完全氧化为FeCl3最好选择下列物质中的_______。
A.酸性KMnO4溶液 B.Cl2 C.Na2O2 D.FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A、B、C分别是三种有机物的结构模型:

请回答下列问题:
(1)A、B两种模型分别是有机物的________模型和________模型。
(2)A及其同系物的分子式符合通式________(用n表示)。当n=________时,烷烃开始出现同分异构体。
(3)A、B、C三种有机物中,所有原子均共面的是________(填名称)。结构简式为CH2=CH(CH2)5CH3的有机物中,处于同一平面内的碳原子数最多为________。
(4)有机物C具有的结构或性质是________(填字母)。
a.是碳碳双键和碳碳单键交替的结构
b.有毒、不溶于水、密度比水小
c.不能使酸性KMnO4溶液和溴水褪色
d.一定条件下能与氢气或氧气反应
(5)等质量的三种有机物完全燃烧生成H2O和CO2,消耗氧气的体积(相同状况下)最大的是________(填分子式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了将混有Na2SO4、NH4HCO3的NaCl提纯。某学习小组设计了如图所示的方案:
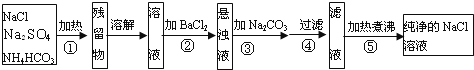
(1)操作①盛放药品的仪器名称是___________,发生反应的化学反应方程式为__________________。
(2)进行操作②后,如何判断杂质是否除尽?_______________________________________________。
(3)操作③的目的是_____________________。
(4)请你评价该设计方案设计是否严密?若不严密,请说明理由,并提出改进方案_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与平衡移动原理无关的是
A. 向含酚酞的Na2CO3溶液中滴加BaCl2溶液,红色变浅
B. 加热MgCl2·6H2O固体最终得到Mg(OH)Cl
C. 将FeS2矿石粉碎更有利于焙烧制备SO2气体
D. NO2气体经过冷凝和加压成无色液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列仪器或装置,请回答下列问题:
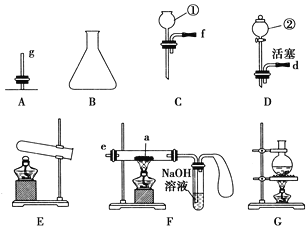
(1)仪器①的名称是________,②的名称是________。
(2)用上图仪器组装成气体发生装置:用KClO3和MnO2制O2应选的装置是________(填字母);用废H2O2与MnO2制O2,并控制产生O2的速率,应选________(填字母)。
(3)若用装置X进行“排空气法”收集制取的O2,氧气应从________(填“b”或“c”)端导入。若瓶中装满水,用排水法收集氧气,氧气应从________(填“b”或“c”)端导入。
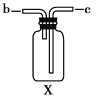
(4)若用F装置进行CO还原Fe2O3的实验,实验室制取CO的方法一般采取甲酸脱水法(HCOOH![]() CO↑+H2O),用纯净的CO完成该实验。
CO↑+H2O),用纯净的CO完成该实验。
①除F、X外还需要的装置有________,X中应加入的试剂是________,X与其它导管连接的顺序是________(填导管口的序号);
②实验时,a处的可能的现象为_________________;F装置中气球的作用是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,22.4LN2和H2混合气中含2NA 个原子
B. 78gNa2O2与足量的CO2完全反应,转移的电子数为2NA
C. 1 L1 mol·L-1NH4Cl溶液中,NH4+的数量为NA
D. 室温下, pH=13的NaOH 溶液中,则溶液中 OH- 离子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实对应的离子方程式或电极反应式书写正确的是( )
A. 用石墨作电极电解CuSO4溶液2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
B. 碳酸钠溶液显碱性:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
C. 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+
D. 在强碱溶液中Fe(OH)3与NaClO反应生成Na2FeO4:3ClO-+2 Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com