
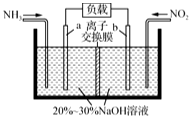
 利用所学化学知识解答下列问题:
利用所学化学知识解答下列问题:分析 ①电极b的电极发生还原反应,二氧化氮转化生成氮气,电极反应式为2NO2+8e-+4H2O═8OH-+N2;标准状况下4.48L NH3的物质的量为:0.2mol,根据4NH3~3NO2进行计算;
②NaHS再与NaVO3反应生浅黄色沉淀是硫单质和Na2V4O9,根据得失电子守恒,得化学方程式为:2NaHS+4NaVO3+H2O═Na2V4O9+2S↓+4NaOH.
解答 解:①电极b的电极发生还原反应,二氧化氮转化生成氮气,电极反应式为2NO2+8e-+4H2O═8OH-+N2;标准状况下4.48L NH3的物质的量为:0.2mol,根据4NH3~3NO2,所以被消除的NO2的物质的量为$\frac{3}{4}$=0.15mol,故答案为:2NO2+8e-+4H2O═8OH-+N2;0.15;
②NaHS再与NaVO3反应生浅黄色沉淀是硫单质和Na2V4O9,根据得失电子守恒,得化学方程式为:2NaHS+4NaVO3+H2O═Na2V4O9+2S↓+4NaOH,
故答案为:2NaHS+4NaVO3+H2O═Na2V4O9+2S↓+4NaOH.
点评 本题考查电极反应式书写,为高考常见题型,侧重于学生的分析能力和计算能力的考查,易错题为①题,会根据化合价的变化确定NO2的电极,然后书写电极反应式.


科目:高中化学 来源: 题型:选择题
| A. | 消耗相同质量的硫酸 | B. | 消耗相同质量的锌 | ||
| C. | 消耗相同质量的氧化铜 | D. | 生成的硫酸锌质量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe→FeCl3 | B. | SiO2→Na2SiO3 | C. | Al2O3→Al(OH)3 | D. | NaO→Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池放电时正极上有气泡产生 | B. | 电池放电时Cl-由负极向正极迁移 | ||
| C. | 正极反应式为Ag++e-=Ag | D. | 负极副反应为Mg+H2O=Mg(OH)2+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镀锡铁制品镀层破损后铁不易被腐蚀 | |
| B. | 相同温度下,pH相同的盐酸和硫酸中水的电离程度相同 | |
| C. | 向饱和石灰水中滴加少量CuC12溶液出现蓝色沉淀,则Ksp[Ca(OH)2]<Ksp[Cu(OH)2] | |
| D. | 合成氨生产中,需将NH3液化分离,目的是加快正反应速率,并提高H2转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原素Z、W的简单离子的电子层结构不同 | |
| B. | Y的最高价氧化物的水化物能与其简单气态氢化物反应生成盐且显碱性 | |
| C. | 由X元素形成的单质不一定是原子晶体 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com