
在淀粉碘化钾溶液中加入少量次氯酸钠溶液。并加入少量的稀硫酸,溶液立即变蓝,在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失。下列判断不正确的是
A.氧化性:ClO->SO42->I2 B.漂白粉溶液可使淀粉碘化钾试纸变蓝
C.向新制氯水中加入足量亚硫酸钠溶液,氯水褪色
D.溶液中次氯酸钠与亚硫酸钠不可共存
科目:高中化学 来源: 题型:
已知H2(g)+Br2(l)=2HBr(g) ΔH=-72kJ·mol-1,蒸发1mol 液溴变Br2(g)需要吸收
的能量为30kJ,其它相关数据如下表:

则表中a为
A.404 B.260 C.230 D.200
查看答案和解析>>
科目:高中化学 来源: 题型:
请按要求填空:
⑴ 下列实验操作或对实验事实的叙述正确的是______________(填序号)
① 用稀HNO3清洗做过银镜反应实验的试管;
② 配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌;
③ 用碱式滴定管量取20.00mL 0.1000mol/L 的KMnO4溶液;
④ 用托盘天平称取10.50g干燥的NaCl固体;
⑤ 不慎将苯酚溶液沾到皮肤上,立即用酒精清洗;
⑥ 用瓷坩埚高温熔融Fe(CrO2)2和Na2CO3的固体混合物;
⑦ 向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体;
⑧ 配制Al2(SO4)3溶液时,加入少量的稀硫酸。
⑵ 为了确定乙醇分子的结构简式是CH3—O—CH3还是CH3CH2OH,实验室利用如图所示的实验装置,测定乙醇与钠反应(△H<0)生成氢气的体积,并据此计算乙醇分子中能与金属钠反应的氢原子的数目。试回答下列问题:
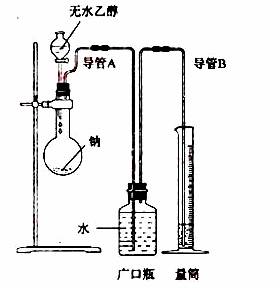
① 指出实验装置中的错误_________________________。
② 若实验中用含有少量水的乙醇代替相同质量的无水乙醇,相同条件下,测得的氢气体积将__________(填“偏大”、“偏小”或“不变”)。
③ 请指出能使该实验安全、顺利进行的关键实验步骤(至少指出两个关键步骤)____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下的两种溶液:①pH=9的NaOH溶液,②pH=9的CH3COONa溶液。对这两种溶液的判断,正确的是
A.两溶液中水的电离程度相同
B.c(Na+):①>②
C.两溶液分别用水稀释10倍后,pH①=pH②<9
D.将①和②等体积混合后的溶液:c(Na+)=c(CH3COO-)+c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是
A.所得溶液中的c(H+)=1.0×10-13mol·L-1
B.所得溶液中由水电离产生的c(OH-)=1.0×10-13 mol·L-1
C.所加的烧碱溶液pH=13.0 D.所得溶液中的c(Mg2+)=5.6×10-10 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是一个制取氯气并以氯气为原料进行特定反应的装置:
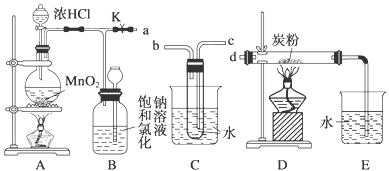
(几种气体的溶解度:常温常压下,1体积的水可溶解CO2、Cl2、HCl分别为1、2、500体积)
(1)A是氯气发生装置,其中的化学反应方程式为 。
(2)要将C装置接入B和D之间,正确的接法是a→______→______ →d
(3)实验开始时,先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯,连接上E装置。Cl2通过C瓶后再进入D。D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为CO2和HCl气体。试写出D中反应的化学方程式: ,装置C的作用是 。为了使C装置发挥更好的作用,可向烧杯中加入浓硫酸,加入浓硫酸的作用是 。
(4)在A、B、C、D、E装置中有一处需要改进,说明需要改进的理由____________________________________________________________________。
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,此时B的作用是 ________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备:FeSO4+Na2CO3=FeCO3↓+Na2SO4 FeCO3+C6H8O7=FeC6H6O7+CO2↑+H2O 下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
(1)制备FeCO3时,选用的加料方式是 (填字母),原因是
。
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是
。
 (3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应。①铁粉的作用是 。②反应结束后,无需过滤,除去过量铁粉的方法是 。
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应。①铁粉的作用是 。②反应结束后,无需过滤,除去过量铁粉的方法是 。
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。分离过程中加入无水乙醇的目的是

 。
。
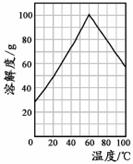
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备绿矾,再合成柠檬酸亚铁。请结合右图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4·7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应,
,得到FeSO4溶液,
,得到FeSO4·7H2O晶 体。
体。
查看答案和解析>>
科目:高中化学 来源: 题型:
如何防止铁的腐蚀是工业上研究的重点内容。为研究铁锈蚀的影响因素,某同学做了如下探究实验:
| 序号 | 内容 | 实验现象 |
| 1 | 常温下将铁丝放在干燥空气中一个月 | 干燥的铁丝表面依然光亮 |
| 2 | 常温下将铁丝放在潮湿空气中一小时 | 铁丝表面依然光亮 |
| 3 | 常温下将铁丝放在潮湿空气中一个月 | 铁丝表面已变得灰暗 |
| 4 | 将潮湿的铁丝放在常温的氧气流中一小时 | 铁丝表面略显灰暗 |
| 5 | 将潮湿的铁丝放在高于常温的氧气流中一小时 | 铁丝表面已变得灰暗 |
| 6 | 将浸过氯化钠溶液的铁丝放在高于常温的氧气流中一小时 | 铁丝表面灰暗程度比实验5严重 |
回答以下问题:
(1)上述实验中发生了电化学腐蚀的是(填实验序号)_______________;在电化学腐蚀中,负极反应是_______________;正极反应是_______________;
(2)由该实验可知,可以影响铁锈蚀速率的因素是_______________;
(3)为防止铁的锈蚀,工业上普遍采用的方法是_______________(答两种方法)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com