
| A����NaHCO3��Һ�е���Ba��OH��2��Һ����������Na2CO3��Һ�м���Ba��OH��2��Һ���ְ�ɫ���� |
| B����������Na2CO3��NaHCO3�ֱ���������ͬŨ�����ᷴӦ��NaHCO3������������� |
| C����������Na2CO3��NaHCO3�ֱ�������ϡH2SO4��Ӧ��NaHCO3������CO2�� |
| D��Na2CO3��NaHCO3���������ᷴӦ���������������Ʒ�Ӧ |
| 1g��1mol |
| 84g |
| 1 |
| 84 |
| 1g��2mol |
| 106g |
| 1 |
| 53 |


 �������Ͽ�ʱͬ��ѵ��ϵ�д�
�������Ͽ�ʱͬ��ѵ��ϵ�д� �������ͬ����ϰϵ�д�
�������ͬ����ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��һ��������þ���Ͻ�Ͷ��100mLһ��Ũ�ȵ������У��Ͻ���ȫ�ܽ⣮��������Һ�еμ�Ũ��Ϊ5mol/L��NaOH��Һ�����ɵij����������NaOH��Һ�������ϵ��ͼ���������������λ��mL��������������λ��g����
��һ��������þ���Ͻ�Ͷ��100mLһ��Ũ�ȵ������У��Ͻ���ȫ�ܽ⣮��������Һ�еμ�Ũ��Ϊ5mol/L��NaOH��Һ�����ɵij����������NaOH��Һ�������ϵ��ͼ���������������λ��mL��������������λ��g�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
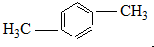
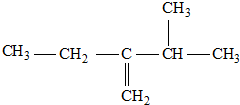

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ͭ�� | B��ͭ�ۺ�þ�ۻ�ϣ������£� |
| C��ˮ�� | D��Ӳ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��FeO��������ϡHNO3��FeO+2H+�TFe2++H2O |
| B��NH4HCO3��Һ������Ba��OH��2��Һ��ϣ�HCO3-+Ba2++OH-�TBaCO3��+H2O |
| C�������ʯ��ˮ��ͨ������CO2��Ca2++2OH-+CO2�TCaCO3��+H2O |
| D����0.2mol/L��NH4Al��SO4��2��Һ��0.4mol/L��Ba��OH��2��Һ�������ϣ�2Al3++3SO42-+3Ba2++6OH-�T2Al��OH��3��+3BaSO4�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��֪��Ӧ2H2��g��+CO��g��?CH3OH��g����ƽ�ⳣ�������������ͬ�����ʵ���Ͷ�ϣ����CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ��ͼ��ʾ�����д�С�Ƚ���ȷ���ǣ�������
��֪��Ӧ2H2��g��+CO��g��?CH3OH��g����ƽ�ⳣ�������������ͬ�����ʵ���Ͷ�ϣ����CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ��ͼ��ʾ�����д�С�Ƚ���ȷ���ǣ�������| ƽ�ⳣ�� | �¶�/�� | ||
| 500 | 700 | 800 | |
| K | 2.50 | 0.34 | 0.15 |
| A��ƽ�ⳣ����K��a����K��c����K��b��=K��d�� |
| B������Ӧ���ʣ�v��a����v��c����v��b��=v��d�� |
| C���ﵽƽ������ʱ�䣺t��a��=t��c����t��b����t��d�� |
| D��ƽ����Է���������M��a��=M��c����M��b����M��d�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| A���٢ڢۢ� | B���ڢۢܢ� |
| C���ڢۢ� | D���٢ڢۢܢ� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com