
| A. | 7.1gCl2与足量的氢氧化钠溶液反应转移的电子数一定为0.2NA | |
| B. | 在常温常压下,11.2 升氯气含有的分子数为0.5NA | |
| C. | 常温常压下,32 g O2和O3的混合气体所含原子数为2NA | |
| D. | 1 molFe与足量的Cl2反应转移的电子数为2NA |
分析 A、求出氯气的物质的量,然后根据氯气和碱的反应为歧化反应来分析;
B、常温常压下,气体摩尔体积大于22.4L/mol;
C、氧气和臭氧均由氧原子构成;
D、铁与氯气反应后变为+3价.
解答 解:A、7.1g氯气的物质的量为0.1mol,而氯气和碱的反应为歧化反应,故0.1mol氯气转移0.1mol电子即0.1NA个,故A错误;
B、常温常压下,气体摩尔体积大于22.4L/mol,故11.2L氯气的物质的量小于0.5mol,故含有的分子数小于0.5NA个,故B错误;
C、氧气和臭氧均由氧原子构成,故32g氧气和臭氧中含有的氧原子的物质的量为n=$\frac{32g}{16g/mol}$=2mol,故为2NA个,故C正确;
D、铁与氯气反应后变为+3价,故1mol铁与氯气反应后转移3mol电子即3NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 放电时,电池的负极反应为LiC6-e-═Li++C6 | |
| B. | 充电时,电池的正极反应为CoO2+Li++e-═LiCoO2 | |
| C. | 羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质 | |
| D. | 锂离子电池的比能量(单位质量释放的能量)低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
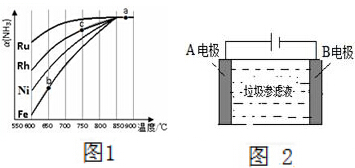 氨气在生产、生活和科研中应用十分广泛.
氨气在生产、生活和科研中应用十分广泛.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | 酸性介质中KMnO4氧化H2O2:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O | |
| C. | HCO3-的电离方程式:HCO3-+H2O═H2CO3+OH- | |
| D. | Cl2与H2O反应:Cl2+H2O═H++Cl-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉胶体加入电解质可发生聚沉现象 | |
| B. | 向Fe(OH)3胶体中加入少量H2SO4溶液,会生成红褐色沉淀 | |
| C. | 可利用丁达尔效应区分胶体与溶液 | |
| D. | 胶体微粒具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
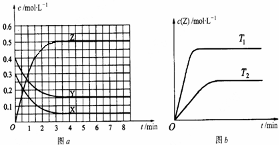
| A. | 该反应的正反应是放热反应 | |
| B. | T0时,该反应的平衡常数为$\frac{1}{3}$ | |
| C. | 反应时各物质的反应速率关系为:2v (X)=2v (Y)=v (Z) | |
| D. | 图a中反应达到平衡时,Y的转化率为37.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液变红 | |
| B. | Na2O与Na2O2组成元素相同、阴阳离子个数比相同,但跟水反应的产物不同 | |
| C. | 只存在共价键的物质一定是共价化台物、离子化合物中一定含有离子键 | |
| D. | 元素原子的最外层电子数越多,得电子能力越强,失电子能力越弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com