
 A��B��C��D��E���ֶ�����Ԫ�أ����ǵ�ԭ��������������AԪ�ص�ԭ�Ӱ뾶��С��BԪ�ص�����������Ӧˮ���������⻯���������Σ�D��Aͬ���壬����Eͬ���ڣ�EԪ��ԭ�ӵ������������ȴ�����������2��A��B��D��E������Ԫ�أ�ÿһ����CԪ�ض����γ�ԭ�Ӹ����Ȳ���ͬ�������ֻ������ش�
A��B��C��D��E���ֶ�����Ԫ�أ����ǵ�ԭ��������������AԪ�ص�ԭ�Ӱ뾶��С��BԪ�ص�����������Ӧˮ���������⻯���������Σ�D��Aͬ���壬����Eͬ���ڣ�EԪ��ԭ�ӵ������������ȴ�����������2��A��B��D��E������Ԫ�أ�ÿһ����CԪ�ض����γ�ԭ�Ӹ����Ȳ���ͬ�������ֻ������ش����� A��B��C��D��E���ֶ�����Ԫ�أ����ǵ�ԭ��������������AԪ�ص�ԭ�Ӱ뾶��С����AΪHԪ�أ�BԪ�ص�����������Ӧˮ���������⻯���������Σ���BΪNԪ�أ�D��Aͬ���壬Dԭ����������N��ԭ����������DΪNa��D��Eͬ���ڣ���E���ڵ������ڣ�EԪ��ԭ�ӵ������������ȴ�����������2������������Ϊ6����EΪSԪ�أ�A��B��D��E������Ԫ�أ�ÿһ����CԪ�ض����γ�ԭ�Ӹ����Ȳ���ͬ�������ֻ��������֪CΪOԪ�أ�
��1��ͬ�������϶���ԭ�ӵõ�������������
A�����ʵķе����������ԣ�
B�����������Ը��۵�Ԫ��������������ǿ��
C���⻯��Խ�ȶ���Ԫ�طǽ�����Խǿ���õ�������Խǿ��
��2��A��B��C��E���γ�������ʽ�Σ������и�����Ԫ�أ���NH4HSO3��NH4HSO4����������ʽ����ˮ��Һ�����Ӧ��
��3��C��D�γɵ�ij�ֻ��������DZˮ����еĹ��������û�����ΪNa2O2�����ɱ�״����11.2LO2�������ʵ���Ϊ$\frac{11.2L}{22.4L/mol}$=0.5mol����2Na2O2��O2���㣻
��4��N2H4��һ�ֿ�ȼ��Һ�壬N2H4�������γɵ�ȼ�ϵ�أ�����Ȼ�����Һ�����������ơ����������������ʱ������������ʧ��������������
���ݵ����غ���㣮
��� �⣺A��B��C��D��E���ֶ�����Ԫ�أ����ǵ�ԭ��������������AԪ�ص�ԭ�Ӱ뾶��С����AΪHԪ�أ�D��Aͬ���壬ԭ������������2����DΪNa��BԪ�ص�����������Ӧˮ���������⻯���������Σ���BΪNԪ�أ�D��Eͬ���ڣ���E���ڵ������ڣ�EԪ��ԭ�ӵ������������ȴ�����������2������������Ϊ6����EΪSԪ�أ�A��B��D��E������Ԫ�أ�ÿһ����CԪ�ض����γ�ԭ�Ӹ����Ȳ���ͬ�������ֻ��������֪CΪOԪ�أ�
��1��ͬ�������϶���ԭ�ӵõ���������������Oԭ�ӵõ�����������ԭ��ǿ��
A�����ʵķе����������ԣ����ܱȽϵõ�������ǿ������A����
B�������γɵĻ������У�OԪ�ص�ԭ���Ը��ۣ�˵����Ԫ�ضԼ��ϵ�������������B��ȷ��
C���⻯��Խ�ȶ���Ԫ�طǽ�����һ�£����ԱȽ���ԭ�ӵõ�����������C��ȷ��
�ʴ�Ϊ������BC��
��2��A��B��C��E���γ�������ʽ�Σ������и�����Ԫ�أ���NH4HSO3��NH4HSO4����������ʽ����ˮ��Һ�����Ӧ�����ӷ���ʽΪ��HSO3-+H+=SO2��+H2O��
�ʴ�Ϊ��HSO3-+H+=SO2��+H2O��
��3��C��D�γɵ�ij�ֻ��������DZˮ����еĹ��������û�����ΪNa2O2�����ɱ�״����11.2LO2�������ʵ���Ϊ$\frac{11.2L}{22.4L/mol}$=0.5mol����2Na2O2��O2��֪���Ĺ�������Ϊ0.5mol��2=1mol��������Ϊ1mol��78g/mol=78g��
�ʴ�Ϊ��78g��
��4��N2H4��һ�ֿ�ȼ��Һ�壬N2H4�������γɵ�ȼ�ϵ�أ�����Ȼ�����Һ�����������ơ��������������䷴Ӧ�����ӷ���ʽΪ2Cl-+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$ H2��+Cl2��+2OH-�����ʱ������������ʧ����������������Y�����������������������ķ���Ϊ��ʪ��ĵ���-KI��ֽ�����Ҳ�֧�ܿڴ�������ֽ������֤����Cl2������
ÿ����0.1mol����ת�Ƶ���Ϊ0.2mol����N2H4-4e��+4OH��=N2+4H2O��֪���ĵ�N2H4Ϊ0.05mol��
�ʴ�Ϊ��2Cl-+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$ H2��+Cl2��+2OH-����ʪ��ĵ���-KI��ֽ�����Ҳ�֧�ܿڴ�������ֽ������֤����Cl2������0.05mol��
���� ���⿼����λ�á��ṹ�����ʹ�ϵ��Ӧ�ã���Ŀ�Ѷ��еȣ���ȷ�ƶϸ�Ԫ������Ϊ���ؼ���ע����������ԭ�ӽṹ��Ԫ�����ڱ���Ԫ�������ɵĹ�ϵ������������ѧ�����Ӧ�û���֪ʶ��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��10 mL��Ͳ��ȡ5.80 mL �Ҵ���Һ | |
| B�� | �����������Ӧʵ������NaOH��Һ��ȥ�������е����� | |
| C�� | ����ˮ���Գ�ȥ�����е���ϩ | |
| D�� | ʳ�ο��Լ���ƺ�ʳ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
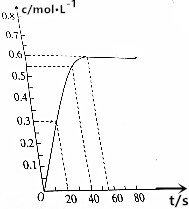 298Kʱ����2L�ĺ����ܱ������У��������淴Ӧ��2NO2��g��?N2O4��g����N2O4�����ʵ���Ũ����ʱ��ı仯��ͼ���ﵽƽ��ʱN2O4��Ũ��ΪNO2��2����
298Kʱ����2L�ĺ����ܱ������У��������淴Ӧ��2NO2��g��?N2O4��g����N2O4�����ʵ���Ũ����ʱ��ı仯��ͼ���ﵽƽ��ʱN2O4��Ũ��ΪNO2��2�����鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com