

| A. | 正极反应为:Zn-2e-═Zn2+ | B. | 电池反应为:Zn+Cu2+═Zn2++Cu | ||
| C. | 当有1mol电子转移时,锌极减轻65g | D. | 盐桥中的K+移向ZnSO4溶液 |
分析 铜锌原电池中,锌较活泼,为原电池的负极,发生Zn-2e-=Zn2+,铜为正极,发生Cu2++2e-=Cu,原电池工作时,溶液中,阳离子向正极移动,结合电极方程式计算.
解答 解:A、铜为正极,发生Cu2++2e-=Cu,故A错误;
B、电池总反应为锌置换出铜,为Zn+Cu2+=Zn2++Cu,故B正确;
C、根据负极发生Zn-2e-=Zn2+可知,当有2mol电子转移时,消耗1mol锌,即锌极减轻65g,故C错误;
D、在溶液中,阳离子往正极移动,K+移向CuSO4溶液,故D错误;
故选:B.
点评 本题考查原电池的工作原理,注意把握工作原理以及电极方程式的书写,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水与碳酸氢钠溶液 | B. | 澄清石灰水与碳酸氢铵溶液 | ||
| C. | 氢氧化钠溶液与碳酸氢钙溶液 | D. | 澄清石灰水与碳酸氢钙溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 玻璃仪器 |
| A | 分离乙醇和乙酸的混合物 | 分液漏斗、烧杯、玻璃棒 |
| B | 用0.10mol/L的盐酸配制 100mL 0.050mol/的盐酸 | 100mL容量瓶、烧杯、玻璃棒、胶头滴管 |
| C | 用溴水、淀粉KI溶液比较 Br2和I2的氧化性强弱 | 试管、胶头滴管 |
| D | 用NH4Cl固体和Ca(OH)2固体制备并收集NH3 | 酒精灯、烧杯、导管、集气瓶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴苯中的溴(KI溶液) | B. | 乙烷中的乙烯(酸性KMnO4溶液) | ||
| C. | 硝基苯中的NO2(NaOH溶液) | D. | 苯中的己烯(Br2水) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
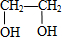 $→_{△}^{浓H_{2}SO_{4}}$ C
$→_{△}^{浓H_{2}SO_{4}}$ C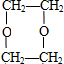 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28.1 | B. | 30.2 | C. | 33.1 | D. | 34.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L-1 | 0.08 | 0.20 | 0.44 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com