
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是
A. 常温常压下,14 g C2H4、C3H6的混合气体中含有碳原子的数目为NA
B. 常温下, pH =12的Na2CO3溶液中含有的OH-离子数为0. 01NA
C. 标准状况下,0.56 L丙烷中含有共价键的数目为0.2 NA
D. 7.8 g Na2O2中含有的阴离子数为0.2NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,B的相对分子质量为78。回答下列问题:
(1)A的电子式_______,B的结构简式_____________________。
(2)与A相邻的同系物C使溴的四氯化碳溶液褪色的化学反应方程式:___________________。
(3)在碘水中加入B振荡静置后的现象________________。
(4)B与浓硫酸和浓硝酸在50~60℃反应的化学反应方程式:_____________________________,反应类型:________。
(5)等质量的A、B完全燃烧时消耗O2的物质的量________(填A>B、A<B或A=B”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电化学法制备LiOH的实验装置如图,采用惰性电极,a口导入LiCl溶液,b口导入LiOH溶液,下列叙述不正确的是( )

A. 通电后阳极区产生的气体是氯气,阴极区产生的气体是氢气
B. 阴极区的电极反应式为4OH-–4e-=O2↑+2H2O
C. 当电路中通过1mol电子的电量时,会有0.5mol的Cl2生成
D. 通电后Li+通过交换膜向阴极区迁移,LiOH浓溶液从d口导出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图一致的是( )
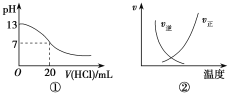
A.图①表示25 ℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液,溶液的pH随加入盐酸体积的变化
B.图②中曲线表示反应N2(g)+O2(g)2NO(g) ΔH>0,正、逆反应速率随温度的变化
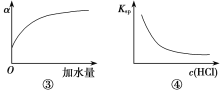
C.图③中曲线表示10 mL 0.01 mol·L-1醋酸的电离度α随加水量的变化
D.图④中曲线表示AgCl的溶度积Ksp随盐酸浓度c(HCl)的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨炸弹爆炸时能在方圆几百米范围内撒下大量石墨纤维,造成输电线、电厂设备损坏.这是由于石墨( )
A.有放射性
B.易燃、易爆
C.能导电
D.有剧毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)冶炼铜的反应为8CuFeS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2若CuFeS2中Fe的化合价为+2,反应中被还原的元素是____________(填元素符号)。
8Cu+4FeO+2Fe2O3+16SO2若CuFeS2中Fe的化合价为+2,反应中被还原的元素是____________(填元素符号)。
(2)冶炼铜的主要流程如下:

气体A中的大气污染物可选用下列试剂中的_______吸收。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液
用稀HNO3浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,一位同学由此得出该熔渣中铁元素价态为+3的结论。请指出该结论是否合理并说明理由________。
(3)冶炼出的铜可以发生下列反应
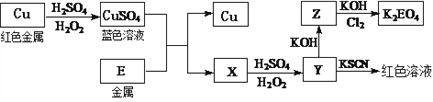
写出Cu溶于稀H2SO4和H2O2混合液的离子方程式:___________________。
写出Cl2将Z氧化为K2EO4的化学方程式:_____________________。
对于0.1molL-1 CuSO4溶液,正确的是_______
A、常温下,pH>7
B、 c(Cu2+)>c(SO42―)>c(H+)>c(OH―)
C、c(H+)+2 c(Cu2+)= 2c(SO42―)+c(OH―)
查看答案和解析>>
科目:高中化学 来源: 题型:
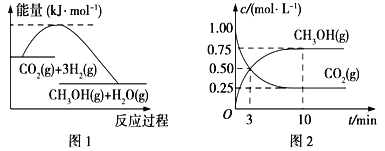
【题目】实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
(1)关于该反应的下列说法中,正确的是____________(填字母)。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4mol H2,一定条件下发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CO2的平均反应速率v(CO2)=_________;
②下列措施中能使化学平衡向正反应方向移动的是___________(填字母)。
A.升高温度B.将CH3OH(g)及时液化抽出C.选择高效催化剂D.再充入l molCO2和4 molH2
(3)25℃,1.01×105Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式:_____________。
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极的电极反应式是:______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com