
(15分)甲醇可通过将煤的气化过程中生成的CO和H2在一定条件下,发生如下反应制得: 。请根据图示回答下列问题:
。请根据图示回答下列问题:
(1) 从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=________。
(2) 写出该反应的热化学方程式________________
(3) 恒容条件下,下列措施中能使 增大的有________________
增大的有________________
A升高温度 B充人He气
C再充入1molCO和2mol H 2 D使用催化剂
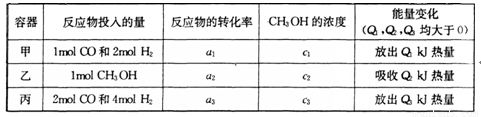
(4) 若在温度和容器相同的三个密闭容器中,按不同方式投人反应物.,测得反应达到平衡吋的有关数据如下表:
则下列关系正确的是________
A c1=c2 B. 
C. 2a1=a3 D. a1 +a2 =1
E该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量
(5) 若在一体积可变的密闭容器中充入l mol CO 2mol H2和1mol CH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向________(填“正”、“逆”)反应方向移动,理由是________________
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
(15分)甲醇可通过将煤的气化过程中生成的CO和H2在一定条件下,发生如下反应制得:。请根据图示回答下列问题:
(1) 从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=________。
(2) 写出该反应的热化学方程式________________
(3) 恒容条件下,下列措施中能使增大的有________________
A升高温度 B充人He气
C再充入1molCO和2mol H2 D使用催化剂
(4) 若在温度和容器相同的三个密闭容器中,按不同方式投人反应物.,测得反应达到平衡吋的有关数据如下表:
则下列关系正确的是________
A c1=c2 B.
C. 2a1=a3 D. a1 +a2 =1
E该反应若生成1molCH3OH,则放出(Q1+Q2)kJ热量
(5) 若在一体积可变的密闭容器中充入l mol CO 2mol H2和1mol CH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向________(填“正”、“逆”)反应方向移动,理由是________________
查看答案和解析>>
科目:高中化学 来源:2011-2012学年贵州省高三第五次月考化学试卷 题型:填空题
(15分)甲醇可通过将煤的气化过程中生成的CO和H2在一定条件下,发生如下反应制得: 。请根据图示回答下列问题:
。请根据图示回答下列问题:

(1) 从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=________。
(2) 写出该反应的热化学方程式________________
(3) 恒容条件下,下列措施中能使 增大的有________________
增大的有________________
A升高温度 B充人He气
C再充入1molCO和2mol H 2 D使用催化剂
(4) 若在温度和容器相同的三个密闭容器中,按不同方式投人反应物.,测得反应达到平衡吋的有关数据如下表:
则下列关系正确的是________
A c1=c2 B. 
C. 2a1=a3 D. a1 +a2 =1
E该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量
(5) 若在一体积可变的密闭容器中充入l mol CO 2mol H2和1mol CH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向________(填“正”、“逆”)反应方向移动,理由是________________
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(12分)车载甲醇质子交换膜燃料电池(PEMFC)将甲醇蒸气转化为氢气的工 艺有两种:(1)水蒸气变换(重整)法;(2)空气氧化法。两种工艺都得 到副产品CO。
1.分别写出这两种工艺的化学方程式,通过计算,说明这两种工艺的优缺点。有关资料(298 .15K)列于表3。
表3 物质的热力学数据
物质 | ΔfHm | Sm |
CH3OH(g) | -200.66 | 239.81 |
CO2(g) | -393.51 | 213.64 |
CO(g) | -110.52 | 197.91 |
H2O(g) | -241.82 | 188.83 |
H2 (g) | 0 | 130.59 |
2.上述两种工艺产生的少量CO会吸附在燃料电池的Pt或其他贵金属催化剂表面,阻碍H2的吸附和电氧化,引起燃料电池放电性能急剧下降,为此,开发了除去CO的方法。现有一组实验结果(500K)如表4。

表中PCO、PO2 分别为CO和O2的分压;rco为以每秒每个催化剂Ru活性位上所消耗的CO分子数表示的CO的氧化速率。(1)求催化剂Ru上CO氧化反应分别对CO和O2的反应级数(取整数),写出 速率方程。(2)固体Ru表面具有吸附气体分子的能力,但是气体分子只有碰到空活性位才可能发生吸附作用。当已吸附分子的热运动的动能足以克服固体引力场的势垒时,才能脱附,重新回到气相。假设CO和O2的吸附与脱附互不影响,并且表面是均匀的,以θ表示气体分子覆盖活性位的百分数(覆盖度),则气体的吸附速率与气体的压力成正比,也与固体表面的空活性位数成正比。研究提出CO在Ru上的氧化反应的一种机理如下:
 其中kco,ads、 kco,des分别为CO在Ru的活性位上的吸附速率常数和脱附速率常数,ko2,ads为O2在Ru的活性位上的吸附速率常数。M表示Ru催化剂表面上的活性位。CO在Ru表面活性位上的吸附比O2的吸附强得多。试根据上述反应机理推导CO在催化剂Ru表面上氧化反应的速率方程(不考虑O2的脱附;也不考虑产物CO2的吸附),并与实验结果比较。
其中kco,ads、 kco,des分别为CO在Ru的活性位上的吸附速率常数和脱附速率常数,ko2,ads为O2在Ru的活性位上的吸附速率常数。M表示Ru催化剂表面上的活性位。CO在Ru表面活性位上的吸附比O2的吸附强得多。试根据上述反应机理推导CO在催化剂Ru表面上氧化反应的速率方程(不考虑O2的脱附;也不考虑产物CO2的吸附),并与实验结果比较。
3.有关物质的热力学函数(298.15 K)如表5。
表5 物质的热力学数据
物质 | ΔfHm | Sm |
H2 (g) | 0 | 130.59 |
O2(g) | 0 | 205.03 |
H2O (g) | -241.82 | 188.83 |
H2O (l) | -285.84 | 69.94 |
在373.15K,100kPa下,水的蒸发焓Δvap Hm![]() =40.64kJ?mol-1,在298.15~3
=40.64kJ?mol-1,在298.15~3
73.15K间水的等压热容为75.6 J?K-1?mol-1。(1)将上述工艺得到的富氢气体作为质子交换膜燃料电池的燃料。燃料电池的理论效率是指电池所能做的最大电功相对于燃料反应焓变的效率。在298.15K,100 kPa下,当1 molH2燃烧分别生成H2O(l) 和 H2O(g)时,计算燃料电池工作的理论效率,并分析两者存在差别的原因。(2)若燃料电池在473.15 K、100 kPa下工作,其理论效率又为多少(可忽略焓 变和嫡变随温度的变化)?(3)说明(1)和(2)中的同一反应有不同理论效率的原因。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
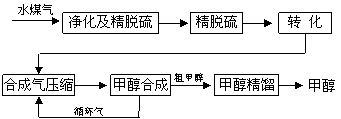
将煤气化转化成合成气,然后通过一碳化工路线合成各种油品和石化产品是一碳化工的极为重要的领域,具有广阔的前景,在未来相当一段时期将成为一碳化工的主要领域。除去水蒸气后的水煤气含55~59%的H2,15~18%的CO,11~13%的CO2,少量的H2S、CH4,除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成。
水煤气法制甲醇工艺流程框图如下
 |
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g)![]() CO(g)+H2(g),此反应是吸热反应。① 此反应的化学平衡常数表达式为 ;
CO(g)+H2(g),此反应是吸热反应。① 此反应的化学平衡常数表达式为 ;
②下列能增大碳的转化率的措施是 ;(填字母代号)
A.加入C(s) B.加入H2O(g) C.升高温度 D.增大压强
(2)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,
主要反应如下: 2H2(g) + CO(g) ![]() CH3OH(g);ΔH =-90.8kJ·mol-1,T4℃下此反应
CH3OH(g);ΔH =-90.8kJ·mol-1,T4℃下此反应
的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组
分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol·L-1) | 0.2 | 0.1 | 0.4 |
① 比较此时正、逆反应速率的大小:v正 v逆 (填“>”、“<”或“=”)。
② 若加入CO、H2后,在T5℃反应10min达到平衡,c(H2)=0.4 mol·L-1,则该时间内反应速率v(CH3OH) = mol-1·(Lmin)-1。
(3)生产过程中,合成气要进行循环,其目的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com