
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.1 mol羟基与17 g NH3所含电子数都为NA
B.12.4 g白磷(分子式为P4)中含有P—P共价键0.6NA
C.电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32 g
D.适量铜粉溶解于1 L 0.5 mol/L稀硝酸中,当生成2.24 L NO时,溶液中氮原子数为0.4NA
科目:高中化学 来源:2014高考化学名师选择题专练 电解质溶液练习卷(解析版) 题型:选择题
一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数Ksp=cm(An+)×cn(Bm-),称为难溶电解质的溶度积。25 ℃时,在AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最后生成黑色沉淀。已知有关物质的颜色和溶度积如下:
物质 | AgCl | AgI | Ag2S |
颜色 | 白 | 黄 | 黑 |
Ksp(25 ℃) | 1.8×10-10 | 1.5×10-16 | 1.8×10-50 |
下列叙述不正确的是( )
A.溶度积小的沉淀可以转化为溶度积更小的沉淀
B.若先加入Na2S溶液,再加入KI溶液,则无黄色沉淀产生
C.25 ℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同
D.25 ℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 化学反应中的能量变化练习卷(解析版) 题型:选择题
目前人们掌握了可充电锌—空气电池技术,使这种电池有了更广泛的用途。这种电池使用特殊技术吸附空气中的氧,以苛性钠为电解质,电池放电时的总反应为2Zn+O2 2ZnO,下列判断正确的是( )
2ZnO,下列判断正确的是( )
A.放电时,OH-向负极方向移动
B.放电时,正极反应式为Zn+2OH--2e- ZnO+H2O
ZnO+H2O
C.充电时,Zn发生氧化反应
D.充电时,阴极反应为O2+2H2O+4e- 4OH-
4OH-
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 化学与STSE练习卷(解析版) 题型:选择题
PM2.5是指大气中直径小于或等于2.5微米的颗粒物,严重危害人体健康,也称为可入肺颗粒物。近年来我国PM2.5污染问题日益凸显。2012年长沙市开展PM2.5和臭氧监测,每天都公布空气质量级别。下面所列各项,在空气质量日报中完全正确的是( )
①可吸入颗粒物 ②总悬浮颗粒物 ③氢氧化物 ④二氧化碳 ⑤二氧化硫 ⑥二氧化氮 ⑦一氧化碳 ⑧一氧化氮 ⑨氮气 ⑩臭氧
A.①③⑤⑦⑨ B.②③⑤⑥⑦
C.②④⑥⑦⑩ D.①⑤⑥⑦⑩
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 元素周期表元素周期律练习卷(解析版) 题型:选择题
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍也是Y原子最外层电子数的3倍。下列说法正确的是( )
A.Y与Z形成的简单离子核外电子排布相同
B.X的氧化物为离子化合物
C.Z的氢化物的水溶液在空气中容易变质
D.X与Z对应的氧化物的水化物一定为强酸
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 NA的应用练习卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g
B.在熔融状态下,1 mol NaHSO4完全电离出的阳离子数为2NA
C.78 g Na2O2固体与H2O完全反应转移的电子数为NA
D.5.6 g铁粉在2.24 L(标准状况)氯气中充分燃烧,失去的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 物质结构与性质练习卷(解析版) 题型:填空题
下表为周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于d区的元素是 (填编号)。
(2)元素⑥形成的最高价含氧酸根的立体构型是 ,其中心原子的杂化轨道类型是 。
(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是 。
A.分子中含有氢键
B.属于非极性分子
C.含有4个σ键和1个π键
D.该氢化物分子中,②原子采用sp2杂化
(4)某元素的特征电子排布式为nsnn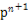 ,该元素原子的核外最外层电子的孤电子对数为 ;该元素与元素①形成的分子X构形为 ;X在①与③形成的分子Y中的溶解度很大,其主要原因是 。
,该元素原子的核外最外层电子的孤电子对数为 ;该元素与元素①形成的分子X构形为 ;X在①与③形成的分子Y中的溶解度很大,其主要原因是 。
(5)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为 (用对应的元素符号表示)。

查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 有机合成与推断练习卷(解析版) 题型:填空题
有机物D是一种合成抗高血压药的重要通用中间体,其合成路线如下:(已知A是一种芳香酸)
A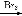

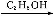 C
C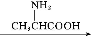
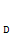
(1)A、C的结构简式分别是 、 ,D中含有的含氧官能团名称是 。
(2)C→D的反应类型是 。
(3)加热条件下,C在足量NaOH水溶液中反应的化学方程式是 。
(4)E是一种相对分子质量比A小14的芳香酸。写出满足下列条件的E的所有同分异构体的结构简式: 。
①能发生银镜反应
②一定条件下可发生水解反应
③分子的核磁共振氢谱中有四组峰
(5)F是B在碱溶液中水解后再酸化的产物。F在一定条件下可聚合成高分子化合物,写出该反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题9溶液中的电离平衡练习卷(解析版) 题型:填空题
已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH CH3COO-+H+ ΔH>0。
CH3COO-+H+ ΔH>0。
(1)常温下,在pH=5的稀醋酸溶液中,c(CH3COO-)= (列式,不必化简);下列方法中,可以使0.10 mol·L-1 CH3COOH的电离程度增大的是 。
a.加入少量0.10 mol·L-1的稀盐酸
b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1
d.加入少量冰醋酸
e.加入少量氯化钠固体
f.加入少量0.10 mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸) V(醋酸),反应的最初速率为:v(盐酸) v(醋酸)(填“>”、“<”或“=”)。
(3)常温下,向体积为Va mL,pH为3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va与Vb的关系是 。
(4)常温下,将0.1 mol/L盐酸和0.1 mol/L醋酸钠溶液混合,所得溶液为中性,则混合溶液中各离子的浓度按由大到小排序为 。
(5)已知:90 ℃时,水的离子积常数为KW=3.8×10-13,在此温度下,将pH=3的盐酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)= (保留三位有效数字) mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com