
甲、乙、丙、丁是由H+、Na+、Al3+、Ba2+、OH—、Cl—、HCO3—离子中的两种组成,可以发生如图转化,下列说法不正确的是
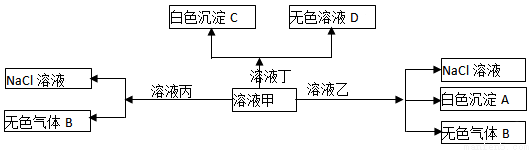
A.在甲中滴加丁可能发生反应:HCO3—+ Ba2++OH—= BaCO3↓+ H2O
B.溶液丙中还可以大量共存的离子有:I—、NO3—、SO42—
C.白色沉淀A可能溶解在溶液D中
D.甲为NaHCO3,乙为 AlCl3
 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源:2015-2016学年甘肃兰州一中高二上期中测试文科化学试卷(解析版) 题型:选择题
下列气体中,不能用排水集气法收集的是
(A)CH4 (B)C2H4 (C)C2H2 (D)NH3
查看答案和解析>>
科目:高中化学 来源:2016届湖南省常德市高三上学期第三次月考化学试卷(解析版) 题型:选择题
下列类比关系正确的是
A.钠与氧气反应可生成两种不同的氧化物,则Li与氧气反应反应也能生成Li2O或Li2O2
B.Na2O2与CO2反应生成Na2CO3和O2,则Na2O2与SO2反应可生成Na2SO3和O2
C.Fe与Cl2反应生成FeCl3,则Fe与I2反应可生成FeI3
D.Al与Fe2O3能发生铝热反应,则Al与MnO2也能发生铝热反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古巴彦淖尔高二上10月月考化学试卷(解析版) 题型:选择题
向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图1所示.图2为t2时刻后改变容器中条件,平衡体系中速率随时间变化的情况,且四个阶段都各改变一种条件,所用条件均不同.已知t3~t4阶段为使用催化剂.下列说法错误的是
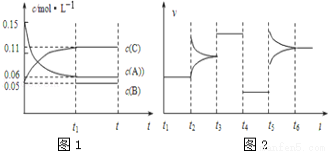
A. 若t1=15s,生成物C在 t0~t1时间段的平均反应速率为0.004 mol•L﹣1•s﹣1
B. t4~t5阶段改变的条件为减小压强,t5~t6阶段改变的条件是升高化学反应的温度
C. B的起始物质的量为0.02 mol
D. 该化学反应的表达式为:3A(g)?B(g)+2C(g)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古巴彦淖尔高一上10月月考化学试卷(解析版) 题型:选择题
实验室中需要配制1mol/L的NaCl溶液970mL,配制时应选用的容量瓶的规格是
A.950mL 容量瓶 B.500mL容量瓶
C.1000mL 容量瓶 D.任意规格的容量瓶
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上学期第一次月考化学试卷(解析版) 题型:选择题
乙醇的燃烧热为ΔH1,甲醇的燃烧热为ΔH2,且ΔH1<ΔH2,若乙醇和甲醇的混合物1 mol完全燃烧,反应热为ΔH3,则乙醇和甲醇的物质的量之比为
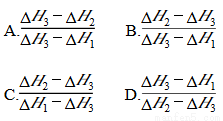
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二上学期9月月考化学试卷(解析版) 题型:选择题
在25℃、1.01×105Pa时,1gCH4燃烧时生成CO2与液态H2O,放出55.6kJ的热量,则CH4的燃烧热为
A.55.6kJ/mol B.889.6kJ/mol C.-889.6kJ/mol D.444.8kJ/mol
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三上学期第一次月考化学试卷(解析版) 题型:填空题
有下列化学仪器:①量筒 ②烧杯 ③容量瓶 ④胶头滴管 ⑤细口试剂瓶 ⑥标签纸
(1)现需要配制500 mL 1 mol·L-1的硫酸溶液,需用质量分数为98%、密度为1.84 g·cm-3的浓硫酸______mL。
(2)从上述仪器中,按实验使用的先后顺序,其编号排列是_______________
(3)容量瓶使用前应进行的操作是_______________
(4)若实验遇到下列情况,对硫酸溶液的物质的量浓度的影响 ,下列判断正确的是___________
①用量筒量取硫酸时俯视读数 ②稀释浓硫酸的烧杯中原有少量蒸馏水;
A.①偏低 ②不变 B.①偏低 ②偏低 C.①偏高 ②偏低 D.①偏高 ②不变
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上第二次月考化学试卷(解析版) 题型:实验题
(每空2分,共10分)某同学用中和滴定法测定某烧碱的纯度,实验过程如下:
(1)配制待测液:称取4.1 g固体烧碱样品(杂质不与酸反应)配制成250 mL溶液。
(2)滴定
①用______________量取10.00 mL待测液。
②向锥形瓶中加入几滴酚酞,用0.201 0 mol·L-1的标准盐酸滴定待测烧碱溶液,边滴边摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化,直到_______________________时停止滴定。
(3)数据处理
实验次 序编号 | 盐酸溶液体积 V/mL | 氢氧化钠溶液体积 V/mL |
1 | 19.90 | 10.00 |
2 | 20.10 | 10.00 |
3 | 22.00 | 10.00 |
4 | 20.00 | 10.00 |
根据上述表格,选取合适的数据,计算待测烧碱溶液的浓度为_____________,烧碱的纯度为___________(保留两位小数)。
(4)一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验。某研究性学习小组在实验室中配制盐酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是(多选)
A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏
B.如果实验中需用80 mL的稀盐酸标准溶液,配制时应选用100 mL容量瓶
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀盐酸,则测得的NaOH溶液的浓度将偏大
E.配制溶液时,定容时俯视读数,则导致实验结果偏大
F.中和滴定时,若在最后一次读数时俯视读数,则导致实验结果偏大
G.锥形瓶用蒸馏水洗浄后,有少量蒸馏水残留,则导致实验结果偏小
H.滴定前滴定管尖嘴有气泡,滴定后气泡消失,则导致实验结果偏大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com